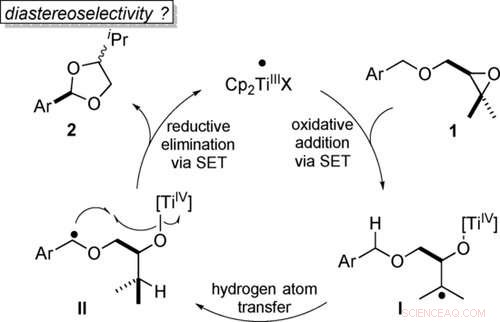
Transformation économique atomique des éthers benzyliques en acétals par catalyse au titanocène(III) en étapes monoélectroniques (SET). Angewandte Chemie, DOI :10.1002/anie.202013561
Les acétals sont des composés chimiques importants qui sont utilisés, par exemple, dans la production de certains agents médicaux. Une nouvelle méthode rend désormais leur synthèse plus facile et plus respectueuse de l'environnement. Des chimistes de l'Université de Bonn ont développé et optimisé le processus catalytique durable. Des simulations informatiques de pointe ont également été utilisées. La réaction est basée sur un mécanisme qui se produit fréquemment dans la nature, mais a rarement été utilisé en synthèse chimique jusqu'à présent. Les résultats sont publiés dans la revue Angewandte Chemie .
L'étape clé de la production d'acétals est la liaison de deux atomes d'oxygène à un atome de carbone. Les chimistes réalisent souvent cet arrangement avec l'oxydation. Des agents oxydants forts sont normalement utilisés pour accomplir cela en libérant un atome d'oxygène pendant la réaction. Le reste de l'agent oxydant doit être éliminé après la synthèse.
« Dans notre étude, cependant, nous décrivons une voie dite atomique-économique, c'est-à-dire qu'il ne génère pas de déchets, " explique le professeur Andreas Gansäuer de l'Institut de chimie organique et de biochimie de Kekulé à l'Université de Bonn. " La molécule de départ elle-même contient déjà l'atome d'oxygène nécessaire à l'oxydation. La catalyse que nous avons développée déplace simplement cet oxygène dans la molécule, qui crée l'acétal."
La molécule de départ contient un groupe dit époxy, une sorte de "triangle" dans lequel deux coins sont formés par des atomes de carbone et le troisième par un atome d'oxygène. Ces triples anneaux sont soumis à une grande tension et se brisent donc facilement au niveau de l'atome d'oxygène. Les époxys stockent l'énergie de réaction nécessaire comme un ressort comprimé.
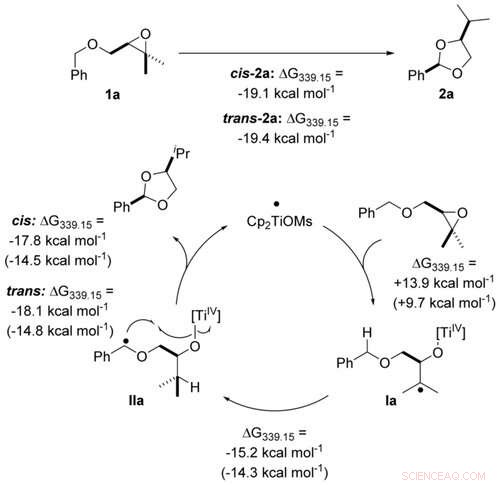
Transformation économique atomique des éthers benzyliques en acétals par catalyse au titanocène(III) par paliers à un seul électron calculé au niveau PW6B95-D4/def2-QZVP + COSMO-RS(THF)//PBEh-3c/DCOSMO-RS(THF). Les valeurs entre parenthèses sont calculées pour le catalyseur Cp2TiCl. Angewandte Chemie, DOI :10.1002/anie.202013561
Catalyse basée sur le modèle de la nature
Pour atteindre cet objectif, un catalyseur approprié est nécessaire. Au sens figuré, les atomes d'oxygène ont deux "bras" avec lesquels ils peuvent former des liaisons. Si l'anneau époxy casse, l'un de ces bras devient libre. Le catalyseur s'y lie maintenant temporairement. Cela initie une séquence de réarrangements internes à la molécule (intramoléculaires). A la fin de cette séquence, l'atome d'oxygène libère à nouveau le catalyseur et se lie à la place au carbone souhaité. "Cette étape s'appelle le rebond d'oxygène, " dit Gansäuer.
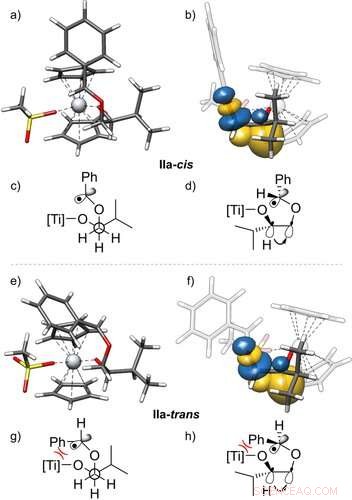
Structures 3D des radicaux IIa‐cis (a, b) et IIa‐trans (e, f) et leur stabilisation par interactions gauches, avec vue latérale. Les orbitales de liaison naturelles (NBO)23 présentées sont obtenues à partir d'un calcul PBEh-3c+CPCM(THF). De plus, les projections de Newman (c, g) et les structures en coin et en tiret (d, h) de ces radicaux sont donnés. Ils montrent l'orbitale de la liaison C−H donnant dans l'orbitale σ*‐de la liaison C−O, visualiser l'effet gauche. Une seule des deux interactions gauches effectives est montrée. Valeur isosurface=0.05 e−1/2 bohr−3/2. Angewandte Chemie, DOI :10.1002/anie.202013561
Ce mécanisme a rarement été utilisé dans les synthèses chimiques à ce jour, contrairement à la nature :le foie, par exemple, utilise le « rebond d'oxygène » pour décomposer les toxines. Cela nécessite également des catalyseurs, les enzymes dites P450. Leur centre actif contient un atome de fer. "Le cœur de notre catalyseur est également constitué d'un métal commun et non toxique, à savoir le titane, " explique le professeur Stefan Grimme de l'Institut de chimie physique et théorique de l'Université de Bonn.
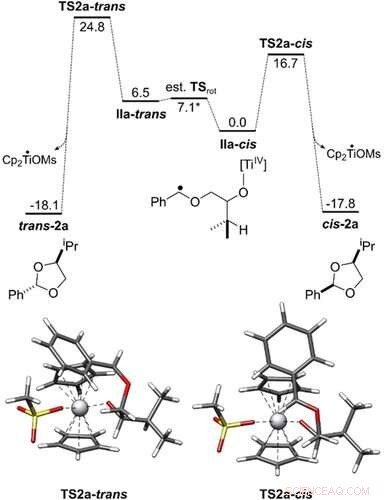
Profil énergétique de la conversion de IIa‐cis et IIa‐trans en cis‐2 a et trans‐2 a. Toutes les énergies libres de Gibbs sont indiquées en kcal mol−1. Les géométries des états de transition ont été obtenues avec PBEh-3c/COSMO(THF). Le cycle catalytique a été étudié au niveau PW6B95-D4/def2-QZVP + COSMO-RS(THF)// PBEh-3c/ COSMO(THF). Angewandte Chemie, DOI :10.1002/anie.202013561
Réglage du catalyseur sur l'ordinateur
Lors de la synthèse de l'acétal, le titane absorbe d'abord un atome d'oxygène puis le libère à nouveau (l'oxydation est suivie d'une dite réduction). Cela ne fonctionne efficacement que s'il lie suffisamment l'oxygène à lui-même sans trop "s'accrocher". Afin d'ajuster son affinité pour l'oxygène de manière appropriée, le titane est lié à certaines molécules, ses ligands. Selon le partenaire de liaison, le métal a alors un effet oxydant un peu plus fort ou peut être réduit plus facilement. Les "molécules de réglage" les plus adaptées sont aujourd'hui sélectionnées à l'aide d'un ordinateur. Le groupe de recherche autour du Pr Grimme s'est spécialisé dans cette tâche :Ces dernières années, elle a développé des algorithmes qui permettent des simulations très rapides des propriétés des catalyseurs.
Cela a permis aux chercheurs dans leur étude d'optimiser leur catalyseur afin qu'il convertisse complètement le matériau de départ en l'acétal souhaité. "Le résultat montre très bien à quel point une coopération étroite entre l'expérience et la théorie est utile pour développer des méthodes de catalyse durables, " dit Gansäuer.