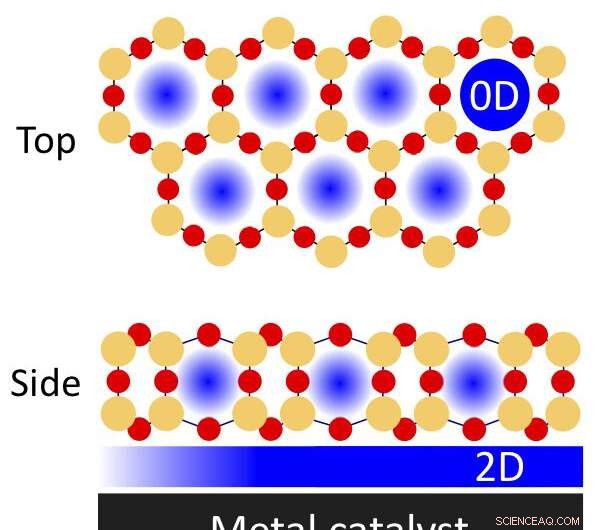
Une illustration d'espaces physiquement confinés dans un film de silice bicouche poreux sur un catalyseur métallique qui peut être utilisé pour des réactions chimiques. Les atomes de silicium sont indiqués par les cercles oranges; atomes d'oxygène par les cercles rouges. Un nanoconfinement peut se produire dans les pores (zéro-dimensionnel, ou 0-D) et la région confinée à l'interface entre le film et le métal (bidimensionnelle, 2-D). Crédit :Laboratoire national de Brookhaven
Les espaces physiquement confinés peuvent permettre des réactions chimiques plus efficaces, selon des études récentes menées par des scientifiques du laboratoire national de Brookhaven du département américain de l'Énergie (DOE). Ils ont découvert que recouvrant partiellement les surfaces métalliques agissant comme catalyseurs, ou des matériaux qui accélèrent les réactions, avec des films minces de silice peut avoir un impact sur les énergies et les vitesses de ces réactions. La silice mince forme un réseau bidimensionnel (2D) de "cages" en forme de prisme hexagonal contenant des atomes de silicium et d'oxygène.
"Ces charpentes de silice poreuse ont l'épaisseur de seulement trois atomes, " a expliqué Samuel Tenney, chimiste au sein du groupe Interface Science and Catalysis du Brookhaven Lab's Center for Functional Nanomaterials (CFN). "Si les pores étaient trop grands, certaines branches de molécules ne pourraient pas atteindre l'interface. Il y a une géométrie particulière dans laquelle les molécules peuvent entrer et se lier, un peu comme la façon dont une enzyme et un substrat se verrouillent ensemble. Des molécules de la taille appropriée peuvent glisser à travers les pores et interagir avec la surface métallique catalytiquement active."
"La silice bicouche n'est pas réellement ancrée à la surface métallique, " a ajouté Calley Eads, un attaché de recherche dans le même groupe. "Il y a des forces faibles entre les deux. Cette faible interaction permet aux molécules non seulement de pénétrer dans les pores, mais aussi d'explorer la surface catalytique et de trouver les sites les plus réactifs et une géométrie de réaction optimisée en se déplaçant horizontalement dans l'espace confiné entre la bicouche et le métal. S'il était ancré, la bicouche n'aurait qu'un seul site de pore pour que chaque molécule interagisse avec le métal."
Les scientifiques découvrent que les espaces confinés modifient différents types de réactions, et ils s'efforcent de comprendre pourquoi.
Tenney et Eads sont des auteurs co-correspondants sur des recherches récemment publiées dans Angewandte Chemie , démontrant cet effet de confinement pour une réaction d'importance industrielle :l'oxydation du monoxyde de carbone. Le monoxyde de carbone est un composant toxique des gaz d'échappement des véhicules et doit donc être éliminé. A l'aide d'un catalyseur de métal précieux approprié tel que le palladium, platine, ou rhodié, les convertisseurs catalytiques des véhicules combinent du monoxyde de carbone avec de l'oxygène pour former du dioxyde de carbone.
Tenney, Eads, et des collègues du CFN et de la National Synchrotron Light Source II (NSLS-II) de Brookhaven ont montré que le fait de recouvrir du palladium avec de la silice augmente la quantité de dioxyde de carbone produite de 20 pour cent, par rapport à la réaction sur palladium nu.
Pour obtenir cette amélioration des performances, les scientifiques devaient d'abord obtenir une structure bicouche complète à travers la surface du palladium. Faire cela, ils ont chauffé une quantité calibrée de silicium à des températures de sublimation dans un environnement d'oxygène à haute pression. En sublimation, un solide se transforme directement en gaz. Au fur et à mesure de la création du film mince de silice, ils ont sondé sa structure par diffraction électronique à basse énergie. Dans cette technique, les électrons frappant un matériau se diffractent selon un motif caractéristique de la structure cristalline du matériau.
"Nous continuons à chauffer jusqu'à ce que nous obtenions des structures hautement cristallines avec des tailles de pores bien définies que nous pouvons utiliser pour explorer la chimie qui nous intéresse, " a déclaré Eads.
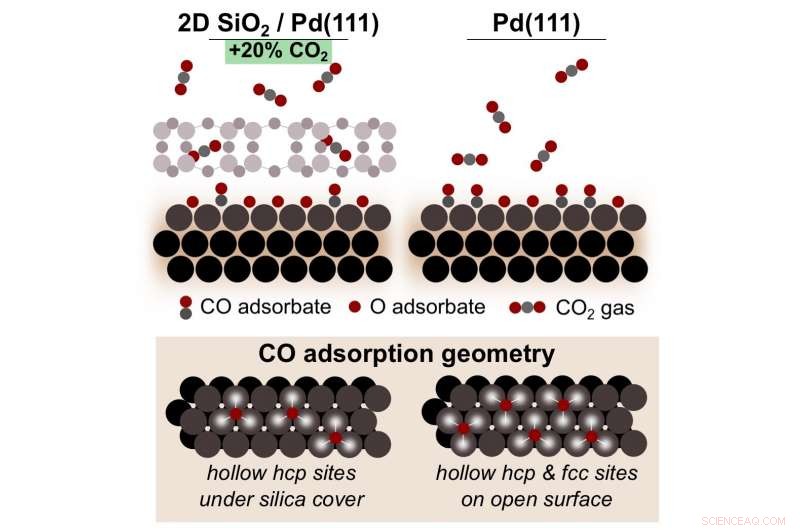
Un schéma montrant comment l'oxydation du monoxyde de carbone (CO) sur le palladium (Pd) sous une silice microporeuse 2-D (SiO, 2) la couverture produit 20 pour cent de plus de dioxyde de carbone (CO
Ici, l'équipe a suivi les réactifs et les produits et l'environnement de liaison chimique dans l'espace confiné 2-D pendant l'oxydation du monoxyde de carbone, augmentant progressivement la température. Pour suivre ces informations, ils ont mené simultanément la spectroscopie photoélectronique à rayons X à pression ambiante (AP-XPS) et la spectrométrie de masse (MS) au NSLS-II et la spectroscopie d'absorption par réflexion infrarouge (IRAAS) au CFN.
"AP-XPS nous indique quels éléments sont présents, qu'ils soient en surface ou en phase gazeuse, " a déclaré Tenney. " Cela peut également nous donner des informations sur l'état d'oxydation chimique ou la géométrie de liaison des atomes - si un carbone est lié à un ou deux atomes d'oxygène, par exemple. MS nous aide à identifier les molécules en phase gazeuse que nous voyons évoluer dans notre système sur la base de leur poids et de leur charge. L'IRRAS est une empreinte digitale du type de liaisons chimiques présentes entre les atomes et montre la conformation et l'orientation des molécules de monoxyde de carbone adsorbées à la surface."
Selon le co-auteur Dario Stacchiola, chef du groupe CFN Interface Science et Catalyse, l'une des capacités uniques de l'équipe est la capacité d'utiliser des outils complémentaires de caractérisation de surface pour analyser le même échantillon sans l'exposer à l'air, ce qui pourrait provoquer une contamination.
« La reproductibilité est souvent un problème en catalyse, " a déclaré Stacchiola. "Mais nous avons une configuration qui nous permet de préparer un échantillon dans des conditions de vide ultra-élevé très vierges et d'exposer le même échantillon à des pressions de gaz industriellement pertinentes."
Les résultats expérimentaux ont montré une forte augmentation de la quantité de dioxyde de carbone au-dessus d'une température critique. En dessous de cette température, le monoxyde de carbone "empoisonne" la surface, empêchant la réaction de se dérouler. Cependant, une fois le seuil de température atteint, l'oxygène moléculaire commence à se diviser en deux atomes d'oxygène individuels à la surface du palladium et forme un oxyde de surface. Ces atomes d'oxygène se combinent avec le monoxyde de carbone pour former du dioxyde de carbone, évitant ainsi l'empoisonnement.
"L'espace confiné modifie l'énergétique et la cinétique de la réaction pour produire plus de dioxyde de carbone, " dit Eads, qui a mené la récente mise en œuvre de cette nouvelle approche d'analyse de surface multimodale pour l'étude des films nanoporeux en conditions opérationnelles.
"En appliquant des couches minces sur un catalyseur traditionnel étudié depuis des décennies, nous avons introduit un "bouton" pour adapter la chimie à certaines réactions, " a déclaré Tenney. " Même une amélioration d'un pour cent de l'efficacité du catalyseur peut se traduire par des économies dans la production à grande échelle. "
"Nous avons découvert qu'une très fine couche d'oxyde peu coûteux peut augmenter considérablement l'activité catalytique sans augmenter la quantité de métal précieux coûteux utilisé comme catalyseur, " ajouta Stacchiola.

Croissance et caractérisation d'un film de silice bicouche à l'aide d'un microscope électronique à basse énergie (LEEM) avec imagerie plein champ. Ce type de microscopie permet aux scientifiques de suivre en temps réel l'évolution de la structure du film au fur et à mesure de sa croissance. La figure (a) montre une surface de palladium propre imagée avec LEEM (grande sphère) et son diagramme de diffraction électronique qui l'accompagne (petite sphère). La figure (b) montre les diagrammes d'imagerie et de diffraction pour la silice bicouche (SiO2) cultivée sur palladium. Crédit :Laboratoire national de Brookhaven
Précédemment, l'équipe a étudié la dynamique de la réaction de l'alcool furfurylique sur une surface de palladium recouverte de silice bicouche. L'alcool furfurylique est une molécule dérivée de la biomasse qui peut être convertie en biocarburant. Par rapport à l'oxydation du monoxyde de carbone, qui ne fabrique qu'un seul produit, les réactions avec des biomolécules plus grosses et plus complexes telles que l'alcool furfurylique peuvent générer de nombreux sous-produits indésirables. Leurs données préliminaires ont montré le potentiel d'ajustement de la sélectivité de la réaction de l'alcool furfurylique avec la couverture de silice bicouche.
"C'est formidable de changer l'activité catalytique - c'est ce que nous voyons dans l'étude sur l'oxydation du monoxyde de carbone, " a déclaré Stacchiola. " La prochaine étape consiste à prouver que nous pouvons utiliser les couvercles d'oxyde pour régler la sélectivité pour des réactions particulières. Nous pensons que notre approche peut être largement appliquée en catalyse. »
L'année dernière, d'autres membres du groupe de Stacchiola, ainsi que des collègues du CFN Theory and Computation Group, Université Stony Brook (SBU), et University of Wisconsin–Milwaukee—ont publié une étude connexe dans Catalyse ACS , un journal de l'American Chemical Society (ACS). Alliant expérience et théorie, ils ont découvert pourquoi la réaction de formation d'eau catalysée par le ruthénium métallique est accélérée sous confinement avec de la silice bicouche.
« La chimie en espace confiné est un domaine de recherche assez nouveau, " a déclaré l'auteur co-correspondant Deyu Lu, un physicien dans le groupe de théorie et de calcul du CFN. « Au cours de la dernière décennie, il y a eu de nombreux rapports que le confinement a un impact sur la chimie, mais une compréhension mécaniste à l'échelle atomique a fait largement défaut."
Dans le Catalyse ACS étudier, l'équipe du CFN a démontré que le confinement peut changer la voie par laquelle la réaction se produit. La formation d'eau peut se faire par deux voies réactionnelles possibles :l'hydrogénation directe et la dismutation. La principale différence réside dans la façon dont le premier groupe hydroxyle, l'oxygène lié à l'hydrogène, est formé. Selon les calculs de Lu et du premier auteur et étudiant à la SBU Mengen Wang, cette étape de réaction coûte le plus d'énergie.
Dans la voie directe, les molécules d'hydrogène se dissocient à la surface en deux atomes d'hydrogène, qui se combinent avec un oxygène absorbé chimiquement à la surface. Ces groupes hydroxyle se combinent avec un autre atome d'hydrogène pour produire de l'eau. Pour la voie de disproportion, l'eau, qui peut encore provenir initialement de la voie directe, doit d'abord être stabilisée en surface. Puis, l'eau peut se combiner avec un oxygène de surface pour former deux groupes hydroxyle à la surface. Ces groupes hydroxyle peuvent se joindre à deux atomes d'hydrogène pour former deux molécules d'eau. Ces molécules d'eau peuvent alors faire plus de groupes hydroxyle, formant une boucle dans la voie de dismutation.
Dans des expériences AP-XPS en laboratoire au CFN, l'équipe a découvert que la température nécessaire pour activer la réaction de formation d'eau était beaucoup plus basse lorsque la silice recouvrait le ruthénium, par rapport au métal lui-même.
"Le fait que la réaction se déroule à des températures plus basses en confinement est en partie lié à sa plus faible énergie d'activation, " a expliqué l'auteur co-correspondant Anibal Boscoboinik, chimiste au sein du groupe CFN Interface Science and Catalysis. "D'après les données AP-XPS sur l'oxygène de surface, nous pouvons indirectement dériver l'énergie nécessaire pour activer la réaction. Nous voyons que cette énergie d'activation est beaucoup plus faible lorsque la silice est au-dessus du ruthénium."
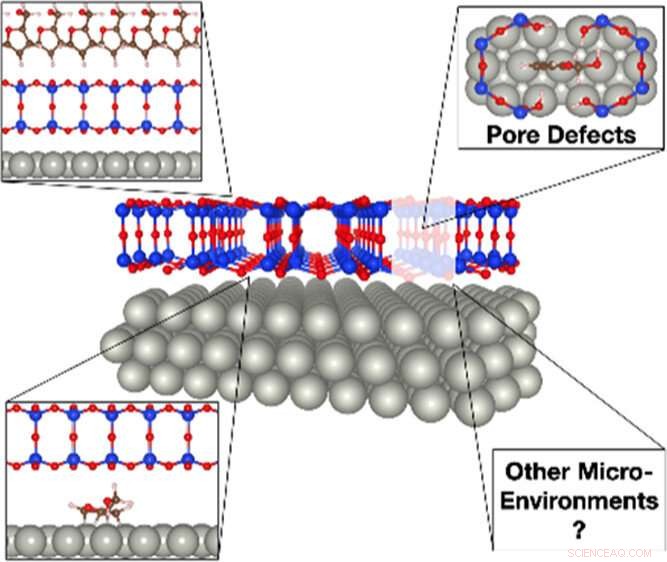
Une illustration de l'impact de la silice bicouche sur la conversion de la biomasse. Les molécules de biomasse encombrantes telles que l'alcool furfurylique ne peuvent s'infiltrer dans le film de silice qu'au niveau des sites de défauts des pores pour interagir avec le palladium catalytiquement actif. Une fois piégé sous la couverture de silice, l'alcool furfurylique peut se décomposer en plusieurs dérivés, notamment le propane, qui est difficile à produire sur la surface ouverte. Crédit :Laboratoire national de Brookhaven
En appliquant une méthode de calcul populaire appelée théorie de la fonctionnelle de la densité, l'équipe a utilisé des superordinateurs pour étudier l'énergétique de la réaction. Initialement, les expérimentateurs ont émis l'hypothèse que l'énergie d'activation réduite pour l'étape limitant la vitesse de la réaction (fabrication du premier groupe hydroxyle) était due à la pression de la silice sur le complexe réactionnel. Cependant, les calculs ont montré que la présence de silice ne modifiait pas significativement cette énergie. Plutôt, il a changé la voie de réaction. Sur la surface nue du ruthénium, la voie directe a été privilégiée; en présence de silice, molécules d'eau stabilisées en surface, activer la voie de disproportion.
"Sans la couverture de silice, les molécules d'eau se désorbent, et la réaction suit la voie directe, " dit Lu. " Sous la couverture de silice, l'eau doit traverser plusieurs barrières d'énergie cinétique pour quitter la surface. Ces barrières cinétiques piègent les molécules d'eau à la surface du métal et activent la voie de dismutation, permettant de fabriquer les groupes hydroxyles à une barrière énergétique beaucoup plus faible, par rapport au cas sans les effets de confinement."
Bien que la formation d'eau ne soit pas pertinente sur le plan industriel, les scientifiques affirment que l'étude de cette réaction modèle peut les aider à comprendre comment tirer parti des effets de confinement pour favoriser certaines voies de réaction pour des réactions plus pertinentes. En d'autres termes, le même principe fondamental peut être appliqué à d'autres systèmes. Par exemple, la silice pourrait être enduite sur des électrodes pour évoquer des voies particulières aux interfaces liquide-solide dans les cellules électrochimiques. Dans ce cas, la réaction serait l'inverse :l'eau serait dissociée en oxygène et hydrogène, un carburant propre.
« Comprendre cette réaction nous aide à comprendre la réaction inverse, " dit Boscoboinik, qui a récemment publié un résumé des premières études sur les effets de confinement avec des films minces poreux 2D. « Si nous étions guidés par la seule expérience, nous aurions attribué la mauvaise explication. La théorie a prouvé que notre hypothèse initiale était incorrecte et a joué un rôle clé dans la révélation du mécanisme de réaction correct au niveau microscopique."
Encore, les scientifiques ont vu d'autres exemples où la silice a un effet lié à la pression. En 2019, ils ont découvert que la silice bicouche exerce une pression sur le gaz noble xénon à l'interface entre la silice bicouche et le ruthénium, induisant une liaison plus forte entre le xénon et le ruthénium.
« Différents effets découlent du confinement, " dit Stacchiola. " C'est très intéressant, riche, et zone largement inexplorée. Nous sommes ravis de continuer à étudier la chimie dans les espaces confinés dans les années à venir."