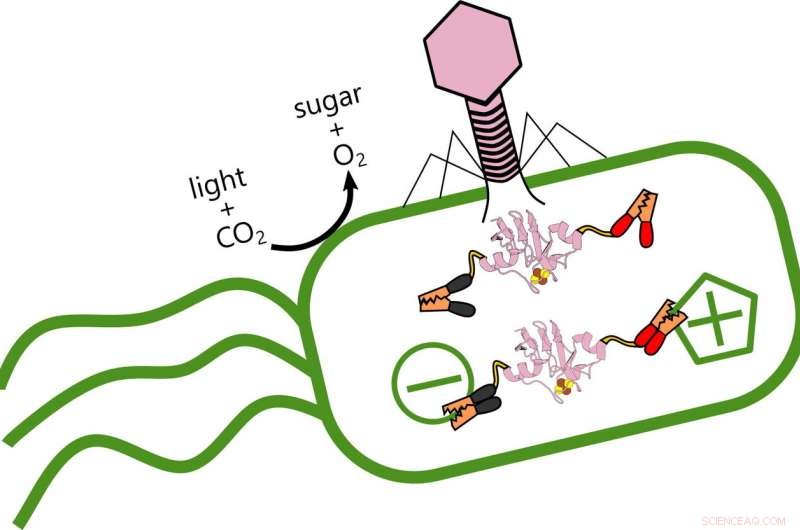
Les scientifiques du riz analysent le rôle des protéines de ferredoxine produites lorsque les phages viraux modifient le transfert d'électrons dans l'océan, bactéries photosynthétiques qui produisent de l'oxygène et stockent du carbone. Lorsque le virus (rose) infecte la bactérie, il produit une protéine ferredoxine qui s'accroche à la structure électrique existante de la bactérie et modifie son métabolisme. Crédit :Ian Campbell
Sous la surface de l'océan, un virus détourne le métabolisme de l'organisme le plus abondant sur Terre. Cela peut intéresser ceux d'entre nous au-dessus qui respirent.
Des scientifiques de l'Université Rice ont analysé le rôle des protéines de ferredoxine produites lorsque les phages modifient la capacité de Prochlorococcus marinus à stocker le carbone et à contrer l'effet de serre résultant de la consommation de combustibles fossiles.
P. marinus est une cyanobactérie photosynthétique qui réside principalement dans les régions tropicales et subtropicales, où environ 10 à 27 (un octillion) d'entre eux utilisent la lumière du soleil pour produire de l'oxygène et stocker collectivement quatre gigatonnes de carbone par an. Une partie de ce carbone fournit des matières premières essentielles pour d'autres organismes marins.
Mais les phages ne sont pas leurs amis. Le virus se renforce en volant l'énergie que les bactéries produisent à partir de la lumière, reprogrammer le génome de sa victime pour modifier la façon dont il transfère les électrons.
P. marinus et son mécanisme de stockage du carbone sont sensibles à la température, il vaut donc la peine de regarder le changement climatique réchauffer les océans et étendre son aire de répartition, dit Ian Campbell, un chercheur postdoctoral Rice et auteur principal de l'étude dans le Journal de chimie biologique .
"La croissance de l'aire de répartition de cet organisme dans les océans pourrait augmenter le carbone total stocké par ces microbes, " dit-il. " Alternativement, les virus qui infectent ces bactéries pourraient altérer la fixation du carbone et empêcher potentiellement des gigatonnes de carbone d'être extraites de l'air chaque année, selon une projection récente."
Campbell a déclaré que l'objectif de l'étude était d'explorer la variété des façons dont les virus interagissent avec leurs hôtes. Dans le processus, les chercheurs ont découvert que le phage contrôle le flux d'électrons dans l'hôte lui-même, recâbler le métabolisme des bactéries. "Quand le virus infecte, il arrête la production des protéines bactériennes et la remplace par ses propres variantes, " at-il dit. "Je compare cela à mettre un système d'exploitation différent dans un ordinateur."
Les chercheurs ont utilisé des techniques de biologie synthétique pour mélanger et assortir des protéines phagiques et cyanobactériennes afin d'étudier leur interaction. Une partie de l'étude dirigée par le biochimiste de Rice, George Phillips, a également déterminé pour la première fois la structure d'une protéine clé de la ferroxine du cyanophage.
"Un phage entrait généralement dans une cellule et tuait tout, " a déclaré le biologiste synthétique de Rice Jonathan Silberg, le scientifique principal de l'étude et directeur des systèmes de l'université, Programme de biologie synthétique et physique.
"Mais les résultats de Ian suggèrent que ces phages établissent un mécanisme de contrôle complexe, " dit-il. " Je ne dirais pas qu'ils ont zombifié leurs hôtes, car ils permettent aux cellules de continuer à faire leur propre ménage. Mais ils se branchent aussi sur leurs propres ferredoxines, comme les câbles électriques, pour affiner le flux d'électrons."
Au lieu de travailler directement avec les cyanophages et P. marinus, Campbell et son équipe ont utilisé des outils de biologie synthétique pour reprogrammer beaucoup plus, bactéries Escherichia coli mieux comprises pour exprimer des gènes qui imitent les interactions entre les deux.
"Prendre un phage et une cyanobactérie dans l'océan et essayer d'étudier la biologie, en particulier le flux d'électrons, serait vraiment difficile à faire avec la biochimie classique, " a déclaré Silberg. " Ian a littéralement pris des partenaires à la fois du phage et de l'hôte, les assembler en codant leur ADN dans un autre système cellulaire, et a pu développer rapidement des résultats intéressants.
"C'est une application intéressante de la biologie synthétique pour comprendre des choses complexes qui seraient autrement difficiles à mesurer, " il a dit.
Les chercheurs soupçonnent la protéine qu'ils ont modélisée dans E. coli, la ferredoxine du phage Prochlorococcus P-SSM2, n'a rien de nouveau. "Les gens savaient que les phages codent différentes choses qui effectuent le transfert d'électrons, mais ils ne savaient pas comment connecter les fils entre le phage et l'hôte, " dit Silberg. " Ils ne savaient pas grand-chose non plus sur l'évolution du phage. La structure indique clairement que ce phage peut être attribué à des protéines ancestrales spécifiques impliquées dans la photosynthèse."