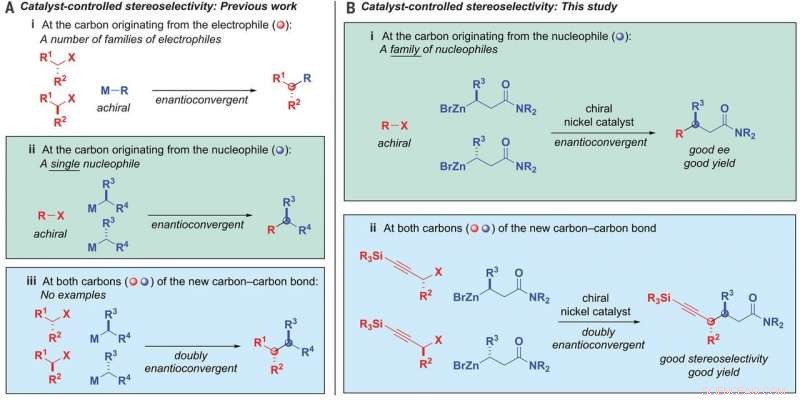
Formation de liaisons alkyle-alkyle. (A) Stéréosélectivité contrôlée par catalyseur - travaux antérieurs. (B) Stéréosélectivité contrôlée par catalyseur - cette étude. ee, excès énantiomérique; M, métal; R, substituant; X, quitter le groupe. Crédit: Science (2020). DOI :10.1126/science.aaz3855
Une équipe de chercheurs du California Institute of Technology a découvert un catalyseur au nickel qui lie les alkylnucléophiles et les alkylélectrophiles pour former un seul stéréoisomère avec deux centres chiraux. Dans leur article publié dans la revue Science , le groupe décrit leur processus. Jianyu Xu et Mary Watson de l'Université du Delaware ont publié un article Perspective sur le travail effectué par l'équipe dans le même numéro de revue.
En chimie, les réactions qui aboutissent à des matériaux avec des liaisons carbone-carbone sont souhaitables car elles sont utilisées dans des applications à grande échelle telles que les produits pharmaceutiques et agricoles. De telles réactions reposent généralement sur des catalyseurs à base de métaux de transition, mais il existe des limitations qui empêchent d'en utiliser beaucoup. Beaucoup ne fonctionnent qu'avec des composés alkyles, ce qui peut conduire à des réactions secondaires indésirables. Aussi, beaucoup de ces réactions aboutissent à des mélanges racémiques de produits, entraînant des inefficacités (les mélanges racémiques sont ceux qui contiennent des quantités égales d'énantiomères gauche et droit d'une molécule chirale).
Lier des mélanges racémiques de deux alkyles tout en maintenant le contrôle de la stéréochimie des deux extrémités du produit a toujours été considéré comme très difficile. Mais maintenant, qui a changé, grâce au travail de l'équipe du CIT, et cela a conduit à un procédé pour effectuer des réactions qui conduisent à des matériaux à liaison carbone-carbone souhaitables.
Dans leur travail, l'équipe a développé un catalyseur au nickel qui permet à un nucléophile alkyle de se lier à un électrophile alkyle. Notamment, les deux sont des composés carbonés racémiques. Ils ont utilisé un ligand bidenté, qui permettait aux points ouverts sur le nickel de se lier à l'oxygène sur les nucléophiles.
La réaction impliquait également l'utilisation d'amides nucléophiles -zincés et d'électrophiles aux halogénures propargyliques. Et il était contrôlé par le catalyseur. En remplaçant les informations chirales dans les deux produits de départ, puis en les rassemblant de manière prédéfinie, les liaisons carbone-carbone se sont formées. Le résultat était un stéréoisomère unique qui avait deux centres chiraux. En utilisant le catalyseur au nickel, le groupe a couplé un mélange racémique avec des nucléophiles et des électrophiles avec jusqu'à 95 pour cent de stéréosélectivité et 82 pour cent de rendement. Les tests ont également montré qu'il était compatible avec 19 groupes fonctionnels.
© 2020 Réseau Science X