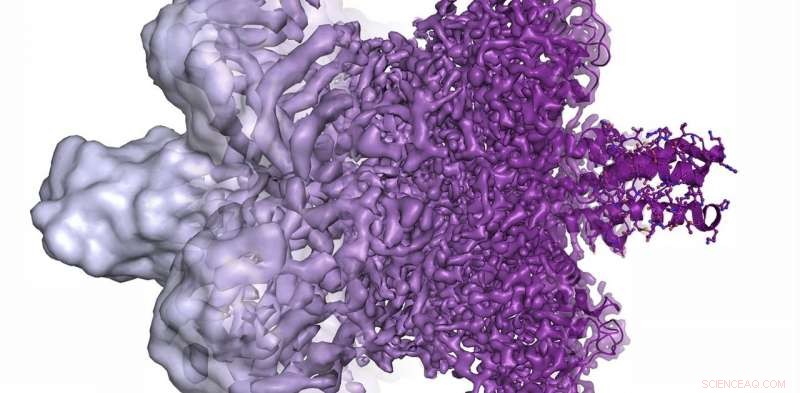
La résolution du microscope électronique s'est radicalement améliorée ces dernières années, de montrer principalement des taches informes (à gauche) en 2013 à maintenant pouvoir visualiser des protéines à une résolution atomique (à droite) dans le présent. Crédit :Martin Högbom/Académie royale des sciences de Suède
Les scientifiques qui ont développé la capacité de voir certains des éléments constitutifs de la vie au microscope électronique ont reçu le prix Nobel de chimie 2017.
Jacques Dubochet, Joachim Frank et Richard Henderson ont été les pionniers de la cryomicroscopie électronique, qui, selon l'Académie royale des sciences de Suède, simplifie et améliore l'imagerie des molécules biologiques, connues sous le nom de biomolécules.
Le prix de 9 millions de couronnes suédoises (1,4 million de dollars australiens) est réparti à parts égales entre Dubochet, à l'Université suisse de Lausanne, Franc, à l'Université Columbia de New York, et Henderson, au Laboratoire de biologie moléculaire du MRC, Cambridge au Royaume-Uni.
L'Académie a déclaré que la méthode développée par les trois chercheurs avait fait entrer la biochimie dans une nouvelle ère. La technologie permet désormais aux chercheurs de générer une vue haute résolution des biomolécules alors qu'elles existent dans leur état naturel.
La serrure et la clé biologiques
Le corps humain est incroyablement complexe et nécessite la coopération d'une gamme de mécanismes biochimiques, comme la digestion et la production d'énergie, pour bien fonctionner. Ces processus complexes impliquent l'utilisation de biomolécules, généralement de grandes entités fabriquées à partir d'acides aminés - les éléments constitutifs de la vie.
Surtout, comme la construction de n'importe quelle maison en briques, la configuration ou le placement des blocs est essentiel à la résistance de notre construction, ou à quel point nos biomolécules fonctionnent.
Par ailleurs, les biomolécules présentent leur capacité à effectuer des tâches en interagissant avec d'autres entités, ces enzymes, dans le corps. Ceux-ci sont basés sur une configuration spécifique, un peu comme la façon dont une seule clé peut ouvrir une serrure particulière.
Le défi de taille relevé par l'équipe primée était de développer la capacité d'observer les biomolécules dans leur état naturel. Avant l'avènement de la cryomicroscopie électronique, ils ont été visualisés par cristallographie aux rayons X.
On pensait aussi que les microscopes électroniques n'étaient adaptés qu'à l'imagerie de la matière morte, car le puissant faisceau d'électrons détruit le matériel biologique.
La percée clé est venue avec le développement d'un procédé pour congeler rapidement un échantillon. Cela a permis de capturer les biomolécules dans leur configuration sur mesure.
L'équipe a identifié très tôt dans son travail que la congélation d'un échantillon avant la visualisation peut apporter l'amélioration requise pour interroger pleinement les biomolécules.
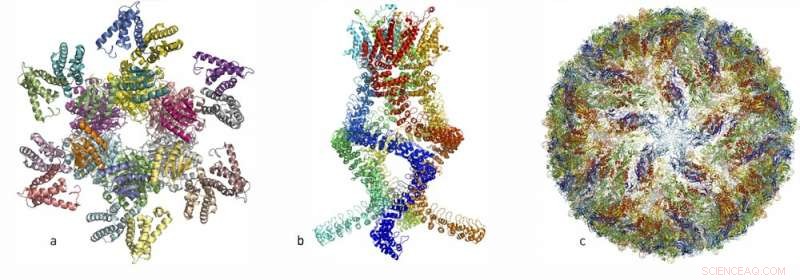
Au cours des dernières années, les chercheurs ont publié les structures atomiques de nombreux complexes protéiques complexes :(à gauche, a) un complexe protéique qui régit le rythme circadien, (centre, b) un capteur du type qui lit les changements de pression dans l'oreille et nous permet d'entendre, et (à droite, c) le virus Zika. Crédit :Académie royale des sciences de Suède
Figé dans le temps
C'est ici que le plaisir commence. Tout en ayant l'air simple par nature, congeler rapidement un échantillon est particulièrement difficile.
Si le processus élimine l'eau de l'échantillon, la biomolécule s'effondre, perdre la configuration naturelle souhaitée par les chercheurs. Si l'échantillon est congelé trop lentement, des cristaux de glace se forment, qui interfère également avec la configuration de la biomolécule.
L'équipe a développé un procédé connu sous le nom de vitrification. Cela gèle l'échantillon à -190℃ pendant qu'il est placé sur un treillis métallique, une approche élégamment simple pour résoudre un problème difficile.
Comme la plupart des réalisations scientifiques lauréates du prix Nobel, le développement était progressif. Les changements apportés par l'équipe sur de nombreuses années ont permis de combiner le processus de congélation (développé en 1978) et la technologie de microscopie qui n'a été pleinement réalisée qu'en 2013.
Cette combinaison et l'avancement de la technologie ont permis l'imagerie à haute résolution de biomolécules.
Débloquer un virus
Donc qu'est-ce que tout cela veut dire? Bien, comprendre la configuration de la serrure permet aux scientifiques de tailler une clé particulière.
Les virus sont de grosses biomolécules. Une fois visualisé, les scientifiques peuvent identifier des molécules ou développer des clés pharmaceutiques pouvant s'insérer dans leur structure afin de les casser ou de perturber leur fonction.
Un exemple de la puissance de la cryomicroscopie électronique est illustré par la caractérisation rapide du virus Zika peu de temps après qu'il a été identifié pour la première fois comme un risque majeur pour la santé mondiale.
L'identification de la configuration du virus et de la poche de la biomolécule qui se joint à son hôte constituera la base des études en cours sur la meilleure façon de lutter contre ce virus.
La technologie a également eu un impact à table. Une équipe de recherche américaine a étudié le composant thermosensible de la langue, mettant en évidence le capteur wasabi. Cela peut offrir la possibilité de mieux comprendre les nouvelles approches de gestion de la douleur.
En Australie, un consortium exploite la puissance de cette technologie pour sonder les maladies liées au système immunitaire afin de développer de meilleurs protocoles de traitement.
La microscopie cryoélectronique sera un domaine passionnant à surveiller dans un proche avenir, pour les serruriers et les passionnés de sciences.
Cet article a été initialement publié sur The Conversation. Lire l'article original. 