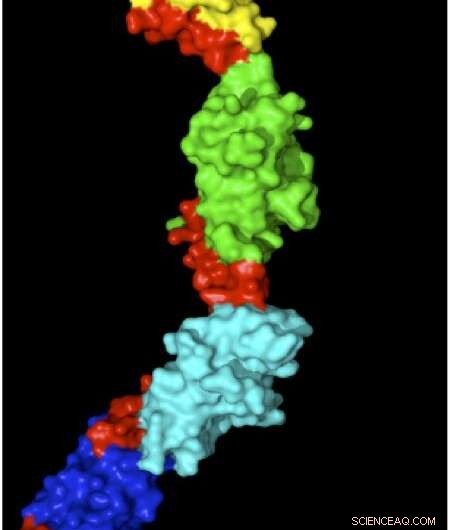
La structure de la myomésine avec des régions élastiques représentées en rouge. Crédit :Matthias Wilmanns
Les protéines fabriquées dans nos cellules sont repliées dans des formes spécifiques afin qu'elles puissent remplir leurs fonctions. Les scientifiques ont découvert les structures statiques de plus de 100, 000 protéines, mais comment ils changent en réponse aux forces sur la cellule, comme les contractions musculaires, est largement méconnu. Matthias Wilmanns et ses collègues du Laboratoire européen de biologie moléculaire à Hambourg, Allemagne, ont développé des méthodes pour étudier la structure d'une protéine « absorbeur de contrainte » lorsqu'elle change au cours des contractions musculaires. Ils présenteront leurs travaux à la 63e réunion annuelle de la Biophysical Society, qui se tiendra du 2 au 6 mars, 2019 à Baltimore, Maryland.
Chaque unité musculaire a une série de tiges de protéines hautement organisées qui sont tirées pour se chevaucher lorsqu'un muscle se contracte ou qui sont séparées lorsqu'un muscle est étiré. La myomésine est une protéine qui stabilise et organise ces bâtonnets, agissant pour absorber la tension sur les muscles étirés pour empêcher les unités musculaires de se séparer. Wilmann, en collaboration avec le groupe de Matthias Rief à l'Université Technique de Munich, utilisé la microscopie à force atomique pour étirer et mesurer des molécules individuelles de myomésine. La myomésine est devenue 2,5 fois plus longue sous la force, et leur structure à haute résolution a montré que cela était dû à des lieurs de type slinky dans la protéine qui lui permettent de s'étirer sans se déplier. Cependant, une question clé demeure sur la démonstration que ces mécanismes s'appliquent également dans des conditions physiologiques. Pour répondre à cette question, Wilmanns et ses collègues conçoivent actuellement des expériences pour visualiser les changements de la myomésine à l'intérieur des cellules musculaires à l'aide d'une imagerie à très haute résolution.
"Le muscle est un bon modèle pour regarder comment ses protéines réagissent à la force, parce qu'il subit des forces extraordinairement élevées, mais nous avons de petites forces sur tout le corps, " a expliqué Wilmanns. " Maintenant, nous avons des méthodes suffisamment sensibles pour mesurer de très petites forces, nous pouvons donc commencer à examiner le comportement de différentes protéines qui répondent à de très petites forces. À l'heure actuelle, on sait si peu sur les mécanismes d'élasticité moléculaire des protéines."