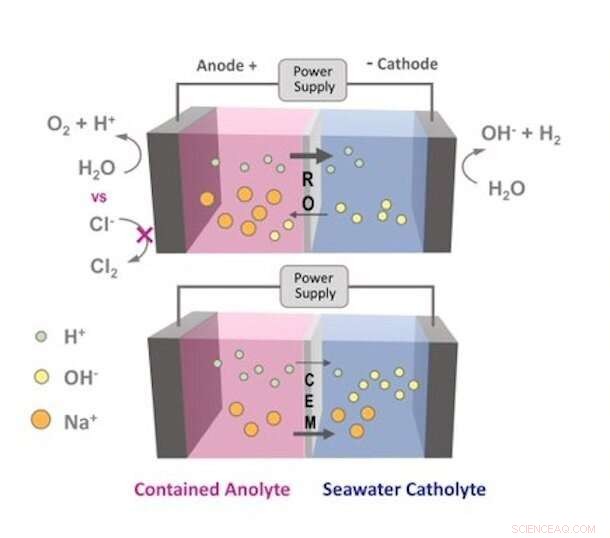
Voici une représentation visuelle de la façon dont le mouvement des ions est affecté par une membrane d'osmose inverse (OI) par rapport à une membrane échangeuse de cations. Les ions chlorure de l'eau de mer ne peuvent pas traverser la membrane RO et s'oxyder en chlore gazeux. Crédit :Logan Research Group
La puissance du soleil, le vent et la mer pourraient bientôt se combiner pour produire de l'hydrogène à combustion propre, selon une équipe de chercheurs de Penn State. L'équipe a intégré la technologie de purification de l'eau dans une nouvelle conception de preuve de concept pour un électrolyseur d'eau de mer, qui utilise un courant électrique pour séparer l'hydrogène et l'oxygène dans les molécules d'eau.
Cette nouvelle méthode de « fractionnement de l'eau de mer » pourrait faciliter la transformation de l'énergie éolienne et solaire en un carburant stockable et portable, selon Bruce Logan, Professeur Kappe en génie de l'environnement et professeur à l'Université Evan Pugh.
"L'hydrogène est un excellent carburant, mais il faut le faire, " Logan a déclaré. "La seule façon durable de le faire est d'utiliser de l'énergie renouvelable et de la produire à partir de l'eau. Vous devez également utiliser de l'eau que les gens ne veulent pas utiliser pour d'autres choses, et ce serait de l'eau de mer. Donc, le Saint Graal de la production d'hydrogène serait de combiner l'eau de mer et l'énergie éolienne et solaire trouvée dans les environnements côtiers et offshore."
Malgré l'abondance de l'eau de mer, il n'est pas couramment utilisé pour le fractionnement de l'eau. À moins que l'eau ne soit dessalée avant d'entrer dans l'électrolyseur - une étape supplémentaire coûteuse - les ions chlorure de l'eau de mer se transforment en chlore gazeux toxique, qui dégrade l'équipement et s'infiltre dans l'environnement.
Pour éviter cela, les chercheurs ont inséré une fine, membrane semipermeable, développé à l'origine pour purifier l'eau dans le processus de traitement par osmose inverse (OI). La membrane RO a remplacé la membrane échangeuse d'ions couramment utilisée dans les électrolyseurs.
"L'idée derrière RO est que vous mettez une pression très élevée sur l'eau et la poussez à travers la membrane et gardez les ions chlorure derrière, " dit Logan.
Dans un électrolyseur, l'eau de mer ne serait plus poussée à travers la membrane RO, mais contenu par elle. Une membrane est utilisée pour aider à séparer les réactions qui se produisent à proximité de deux électrodes immergées - une anode chargée positivement et une cathode chargée négativement - connectées par une source d'alimentation externe. Lorsque l'appareil est sous tension, les molécules d'eau commencent à se séparer à l'anode, libérant de minuscules ions hydrogène appelés protons et créant de l'oxygène gazeux. Les protons traversent ensuite la membrane et se combinent avec des électrons à la cathode pour former de l'hydrogène gazeux.
Avec la membrane RO insérée, l'eau de mer est conservée côté cathode, et les ions chlorure sont trop gros pour traverser la membrane et atteindre l'anode, éviter la production de chlore gazeux.
Mais dans le fractionnement de l'eau, Logan a noté, d'autres sels sont intentionnellement dissous dans l'eau pour la rendre conductrice. La membrane échangeuse d'ions, qui filtre les ions par charge électrique, laisse passer les ions de sel. La membrane RO ne le fait pas.

L'eau de mer peut être convertie en carburant hydrogène en utilisant cette conception pour un électrolyseur d'eau de mer, selon les chercheurs de Penn State. Crédit :Tyler Henderson
"Les membranes RO inhibent le mouvement du sel, mais la seule façon de générer du courant dans un circuit est que les ions chargés dans l'eau se déplacent entre deux électrodes, " dit Logan.
Avec le mouvement des plus gros ions restreint par la membrane RO, les chercheurs devaient voir s'il y avait suffisamment de petits protons se déplaçant à travers les pores pour maintenir un courant électrique élevé.
"Essentiellement, nous devions montrer que ce qui ressemblait à un chemin de terre pouvait être une autoroute, " a déclaré Logan. "Nous devions prouver que nous pouvions obtenir une grande quantité de courant à travers deux électrodes lorsqu'il y avait une membrane entre elles qui ne permettrait pas aux ions de sel de se déplacer d'avant en arrière. "
Grâce à une série d'expériences récemment publiées dans Sciences de l'énergie et de l'environnement , les chercheurs ont testé deux membranes RO disponibles dans le commerce et deux membranes échangeuses de cations, un type de membrane échangeuse d'ions qui permet le mouvement de tous les ions chargés positivement dans le système.
Chacun a été testé pour la résistance de la membrane au mouvement des ions, la quantité d'énergie nécessaire pour achever les réactions, production d'hydrogène et d'oxygène gazeux, interaction avec les ions chlorure et détérioration de la membrane.
Logan a expliqué que même si une membrane RO s'est avérée être un « chemin de terre, " l'autre a bien fonctionné par rapport aux membranes échangeuses de cations. Les chercheurs étudient toujours pourquoi il y avait une telle différence entre les deux membranes RO.
"L'idée peut marcher, " dit-il. " Nous ne savons pas exactement pourquoi ces deux membranes ont fonctionné si différemment, mais c'est quelque chose que nous allons découvrir."
Récemment, les chercheurs ont reçu 300 $, 000 000 de la National Science Foundation (NSF) pour continuer à étudier l'électrolyse de l'eau de mer. Logan espère que leurs recherches joueront un rôle essentiel dans la réduction des émissions de dioxyde de carbone dans le monde.
« Le monde est à la recherche d'hydrogène renouvelable, " dit-il. " Par exemple, L'Arabie saoudite a prévu de construire une installation d'hydrogène de 5 milliards de dollars qui utilisera de l'eau de mer. À l'heure actuelle, ils doivent dessaler l'eau. Peut-être qu'ils peuvent utiliser cette méthode à la place."