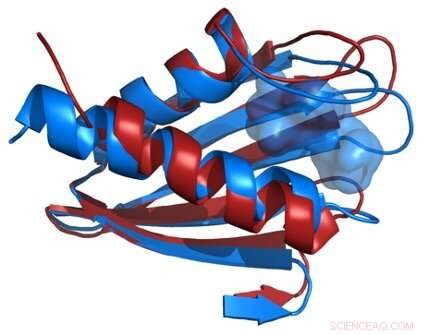
La comparaison des structures du squelette de la protéine Flpp3 dérivée d'un laser à électrons libres à rayons X (rouge) et de la RMN (bleu) révèle une cavité interne unique à la structure RMN et suggère donc l'existence de structures protéiques intermédiaires. Crédit :James Zook
La tularémie est une maladie rare mais souvent mortelle. Elle est causée par l'un des agents pathogènes les plus agressifs sur terre, la bactérie Francisella tularensis. Le microbe, transporté par une variété d'animaux et d'insectes, est capable d'entrer et d'attaquer le corps par une gamme de voies, résultant en différentes constellations de symptômes et de degrés de gravité.
La tularémie reste mal comprise et il n'existe aucun vaccin sûr et efficace contre la maladie. L'extrême létalité de F. tularensis et son potentiel d'aérosolisation en ont également fait un candidat d'arme biologique, accroître l'urgence de comprendre la maladie et de développer des traitements efficaces.
Dans une nouvelle étude, des chercheurs du Biodesign Center for Applied Structural Discovery examinent une protéine membranaire clé responsable de la capacité prodigieuse de la bactérie à infecter le corps et à provoquer des maladies. Ce facteur de virulence, connu sous le nom de Flpp3, est examiné avec des détails sans précédent à l'aide d'un laser à électrons libres à rayons X ou XFEL, un accélérateur de rayons X massif et puissant situé au SLAC National Accelerator Laboratory, Stanford.
La technologie XFEL utilise des flashs de rayons X brillants et extrêmement courts pour sonder des échantillons cristallisés de Flpp3, révélant la structure détaillée de la protéine comme jamais auparavant. En comparant les informations structurelles recueillies par les expériences XFEL avec l'analyse structurelle précédente utilisant la RMN, les chercheurs ont développé un modèle plus complet de la forme élaborée de Flpp3. (Des études antérieures ont montré que lorsqu'un gène codant pour Flpp3 est désactivé, les effets du pathogène F. tularensis sont considérablement diminués.)
Les scientifiques espèrent éventuellement utiliser ces informations pour développer des médicaments ciblés capables de désactiver les propriétés de virulence de la protéine et de protéger contre la tularémie. Les progrès de la compréhension pourraient également aider les scientifiques à développer un vaccin efficace contre la maladie à l'avenir. Actuellement, il n'existe que des vaccins vivants atténués pour la tularémie, et les risques d'infection et d'immunité insuffisante associés à cette approche ont empêché l'utilisation de tels vaccins aux États-Unis.
Le chercheur en biodesign, le Dr James Zook, et les professeurs Petra Fromme et Abhishek Singharoy du Biodesign Center for Applied Structural Discovery ont dirigé la nouvelle étude. Il est rejoint par des collègues internationaux, dont des chercheurs de DESY, SLAC, AstraZeneca, le Laboratoire Européen de Biologie Moléculaire de Grenoble, La France, entre autres.
Petra Fromme, directeur du Center for Applied Structural Discovery explique l'importance des résultats :« Cette étude combine, pour la première fois, techniques XFEL de pointe avec RMN et modélisation moléculaire pour démêler le grand espace conformationnel de Flpp3. L'étude dévoile différentes conformations de cette protéine importante pour la virulence de la bactérie dans la structure XFEL et RMN montrant ainsi la nature hautement dynamique de Flpp3. Cette étude est tellement passionnante car elle montre que des conformations très différentes coexistent et se transforment les unes dans les autres dans des conditions physiologiques."
Visualiser la virulence
En utilisant les données structurelles détaillées de la RMN et la nouvelle analyse XFEL du facteur de virulence de la tularémie, les chercheurs ont identifié un inhibiteur potentiel de Flpp3. Ces informations ont été obtenues à partir de bibliothèques virtuelles disponibles contenant des structures de fragments de médicaments. Prochain, une méthode de modélisation basée sur la physique, connue sous le nom de dynamique moléculaire (DM), fourni des informations détaillées sur les fluctuations et les changements de conformation des atomes et des molécules dans la protéine liée à la virulence, aider les chercheurs à obtenir une lecture plus précise de la structure et du comportement de Flpp3.
"Ce travail fournit plusieurs structures à résolution atomique d'un important facteur de virulence de la bactérie qui cause la tularémie, " selon la chercheuse en biodesign Dr.Debra Hansen, co-auteur de la nouvelle étude. Les configurations de protéines identifiées aideront les chercheurs à poursuivre la conception de médicaments basés sur la structure qui pourraient être efficaces contre la maladie insaisissable, par le ciblage et l'inhibition de Flpp3.
Comme l'explique le co-auteur et chercheur en biodesign, le Dr Abhishek Singharoy, l'étude est remarquable pour être parmi les premières enquêtes sur la flexibilité conformationnelle des protéines découvertes avec la cristallographie aux rayons X femtoseconde en série et la RMN et confirmées à l'aide de simulations de dynamique moléculaire (MD).
Les découvertes du groupe apparaissent dans le numéro actuel de la revue Cell Press Structure .
Menace persistante
Tularémie, également connue sous le nom de fièvre du lapin, est une maladie infectieuse rare, attaque généralement les yeux, peau, ganglions lymphatiques et poumons après infection par la bactérie F. tularensis. La maladie est endémique en Amérique du Nord ainsi que dans de nombreuses régions d'Europe et d'Asie, bien que les cas de tularémie soient rares et que les épidémies à part entière tendent à se limiter aux régions où l'assainissement est médiocre et l'inaccessibilité aux soins de santé modernes.
La tularémie touche principalement les mammifères, en particulier les rongeurs, lapins et lièvres, bien qu'il infecte parfois aussi les oiseaux, mouton, et animaux domestiques, y compris les chiens, chats et hamsters.
La maladie peut se transmettre à l'homme par les piqûres d'insectes et l'exposition directe à un animal infecté. La maladie est extrêmement contagieuse. Seulement 10 cellules bactériennes peuvent être mortelles et une seule bactérie peut suffire à provoquer une infection. L'organisme peut vivre des semaines dans le sol, l'eau et les animaux morts.
La tularémie peut être traitée efficacement si elle est détectée tôt, bien que le régime de traitement puisse être long et complexe. La plupart des personnes infectées par F. tularensis présentent des symptômes dans les trois à cinq jours, bien que cela puisse prendre jusqu'à deux semaines.
La maladie existe sous diverses formes avec des symptômes différents, selon comment et où les bactéries pénètrent dans le corps. Il s'agit notamment de la tularémie ulcéro-glandulaire, la forme la plus courante, qui produit des ulcères de la peau au site d'infection, ganglions lymphatiques enflés et douloureux, fièvre, des frissons, maux de tête et épuisement.
D'autres formes incluent glandulaire, oculoglandulaire, oropharyngé, pneumonique, et la tularémie typhoïde. Si laissé non traité, une variété de complications graves de la maladie peut s'ensuivre, dont la méningite, inflammation des poumons, irritation autour du cœur et infection des os.
Méthode cristal
Dans l'étude actuelle, une technique connue sous le nom de cristallographie aux rayons X femtoseconde en série est utilisée pour sonder la structure de la protéine Flpp3. Ici, des sursauts de rayons X brefs et brillants, environ un milliard de fois plus lumineux que les rayons X conventionnels, frapper un jet de cristaux "volant" à travers le faisceau de rayons X. L'explosion de rayons X intense détruit les cristaux mais avant cela, crée un motif de diffraction sur un écran. Les impulsions de rayons X sont ultracourtes, d'une durée de seulement 40 femtosecondes, qu'ils dépassent les dommages causés par les rayons X, permettant de collecter des données à température ambiante dans des conditions proches de la physiologie. (1 fs =10 -15 secondes ou un quadrillionième de seconde.)
L'assemblage d'un grand nombre de ces clichés aux rayons X à l'aide d'ordinateurs permet l'assemblage d'un Structure 3-D de la protéine à l'étude. Cette méthode dite de diffraction avant destruction a d'abord été mise au point par Henry Chapman au Deutsches Elektronen-Synchrotron (DESY) avec l'équipe de l'ASU sous la direction de John Spence et Petra Fromme et de leurs collaborateurs.
Les chercheurs ont combiné les nouvelles données structurelles XFEL avec leurs précédentes études RMN de Flpp3, observer deux états distincts de la protéine. Les simulations MD ont révélé une structure de cavité interne qui est transitoire, suggérant que Flpp3 subit un changement conformationnel subtil.
L'approche ouvre la porte au développement de médicaments ciblés visant à réduire la létalité de la tularémie et affiche la puissance des technologies combinées pour débloquer les détails de la structure et de la dynamique des protéines.