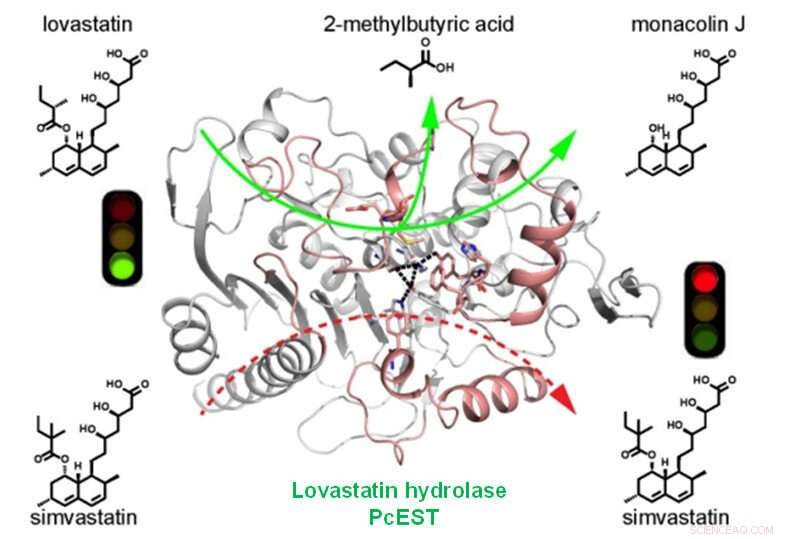
La lovastatine hydrolase PcEST catalyse spécifiquement et efficacement la conversion de la lovastatine en monacoline J, mais ne peut pas hydrolyser la simvastatine Crédit :LIANG Yajing
Hyperlipidémie, l'une des menaces les plus courantes pour la santé humaine, fait référence à une augmentation anormale du cholestérol et/ou des triglycérides dans le sang. Une méthode efficace de prévention et de traitement de la maladie est la thérapie hypocholestérolémiante, comme le médicament simvastatine.
L'hydrolyse alcaline de la lovastatine pour produire la monacoline J est une étape intermédiaire pour obtenir la simvastatine. La synthèse enzymatique utilisant une lovastatine hydrolase spécifique et efficace est l'une des méthodes alternatives pour la production verte de monacoline J.
Récemment, l'équipe de recherche dirigée par le professeur Lu Xuefeng du Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT), Académie chinoise des sciences (CAS), ont révélé le mécanisme catalytique et la relation structure-fonction de la lovastatine hydrolase PcEST, spécifique et efficace.
Il s'agit du premier rapport décrivant le mécanisme et la relation structure-fonction de la lovastatine hydrolase et fournit des informations sur le dépistage ultérieur de la lovastatine hydrolase, ingénierie, et applications commerciales. Les résultats ont été publiés dans le Journal de chimie biologique .
Des analyses biochimiques basées sur la structure et des essais de mutagenèse ont révélé que la triade catalytique Ser-57 (nucléophile)-Tyr-170 (base générale)-Lys-60 (acide général), ainsi que le réseau de liaisons hydrogène autour du site actif et le tunnel de liaison au substrat spécifique déterminent l'hydrolyse efficace et spécifique de la lovastatine par PcEST.
Par ailleurs, en utilisant l'ingénierie enzymatique guidée par la structure, les chercheurs ont développé une variante PcEST, D106A, qui améliore la solubilité et la thermostabilité, suggérant une application prometteuse de cette variante dans les procédés industriels.