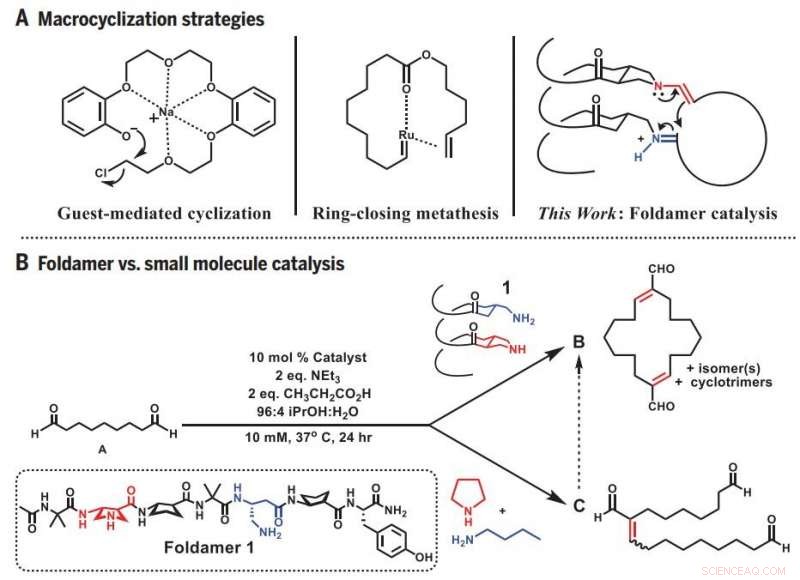
Stratégies de macrocyclisation. (A) Approches antérieures et approche foldamer de la macrocyclisation. (B) Réactivité divergente :Foldamer versus catalyse à petites molécules. éq., équivalent(s). Crédit: Science (2019).DOI : 10.1126/science.aax7344
En s'inspirant de la nature, Les chimistes de l'Université du Wisconsin-Madison ont découvert un moyen efficace de se disputer longtemps, des molécules qui serpentent pour former de grands anneaux, des anneaux qui forment l'épine dorsale de nombreux produits pharmaceutiques, mais qui sont difficiles à produire en laboratoire.
Le travail peut représenter un progrès préliminaire vers le déchiffrement de la façon dont les enzymes, aiguisé par l'évolution, produire si efficacement des composés naturels. Plus immédiatement, la nouvelle méthode pourrait aider les chercheurs à synthétiser des médicaments qui ont de grandes épines dorsales, comme ceux de l'hépatite. La recherche est publiée le 19 décembre dans la revue Science .
La nature préfère le désordre d'une longue, molécule souple de l'ordre d'un anneau rigide, ce qui rend notoirement difficile pour les chimistes d'amadouer de grands anneaux pour se former en laboratoire. "Si les molécules linéaires deviennent assez longues, c'est comme si les extrémités ne savaient plus qu'elles sont connectées, et ils sont tout aussi susceptibles de se lier à d'autres molécules qu'ils le sont de se réunir, " déclare Sam Gellman, professeur de chimie à l'UW-Madison, l'auteur principal du rapport.
Pourtant, les enzymes biologiques peuvent facilement rapprocher ces extrémités et former des anneaux de toutes tailles. Ils accomplissent cet exploit grâce à leur complexe, des formes tridimensionnelles qui agissent comme un verrou spécialisé - la molécule linéaire s'insère comme une clé de la bonne manière pour qu'une réaction organisée ait lieu.
Pour à la fois étudier le fonctionnement des enzymes et imiter leurs capacités, L'équipe de Gellman est devenue beaucoup plus petite, molécules tridimensionnelles ressemblant à des protéines appelées foldamères que leur laboratoire a aidé à développer.
Parce que le foldamer a une forme tridimensionnelle qui peut s'accrocher aux extrémités de la molécule précurseur flexible, cela augmente considérablement les chances que les extrémités se trouvent. À la fois, le foldamère catalyse la bonne réaction qui relie les extrémités en un anneau fermé. Le résultat est la synthèse simple et prévisible d'un défi, et utile, forme moléculaire.
« En tant que chimistes, nous voyons à quel point les enzymes sont extraordinairement efficaces pour faire des réactions difficiles à accomplir dans un flacon, mais nous ne comprenons pas vraiment comment ils fonctionnent, " dit Gellman. " Si nous apprenons comment fonctionnent ces petits catalyseurs de foldamère, nous pourrons peut-être construire des catalyseurs efficaces pour de nombreuses réactions différentes. Finalement, peut-être pouvons-nous nous frayer un chemin vers des foldamères qui ont vraiment une activité semblable à celle d'une enzyme."
L'étudiant diplômé et auteur principal Zebediah Girvin a commencé la recherche en testant les capacités d'un court, plieuse en forme de spirale. Girvin a essayé d'utiliser le foldamère pour plier une molécule linéaire contenant neuf atomes de carbone afin qu'elle forme un anneau. Mais au lieu d'une bague de la taille attendue, Girvin en a obtenu un deux fois plus gros, le résultat de deux molécules précurseurs se joignant d'abord puis fermant le cercle.
"C'est une situation courante en science. Vous essayez quelque chose et cela ne fonctionne pas comme vous l'espériez, " dit Gellman. " Le défi est de reconnaître quand le résultat surprenant est aussi intéressant que l'objectif initial, ou encore plus intéressant."
Guidé par ce hasard, Girvin a commencé à tester à quel point le foldamer pouvait produire les anneaux plus gros qu'il semblait préférer créer. Il a découvert qu'il pouvait facilement fabriquer des anneaux composés de 12 à 22 atomes de carbone lorsque les sites réactifs du foldamère, où se produit la fermeture de l'anneau, étaient alignés les uns avec les autres d'un côté. Cette orientation a rapproché suffisamment les deux extrémités de diverses molécules linéaires pour fusionner.
Comme preuve de concept pour la nouvelle technique, Girvin a synthétisé le Robustol, un produit naturel à partir de zéro. Dérivé des feuilles du chêne soyeux australien, Robustol pèse avec un anneau lourd de 22 atomes.
L'équipe de Gellman est très enthousiasmée par le potentiel des foldamères à catalyser d'autres réactions utiles et éventuellement à aider à élucider les mystères de longue date sur la façon dont les enzymes, les virtuoses chimiques de la nature, produire les molécules nécessaires à la vie simplement en disposant les blocs de construction d'acides aminés dans la bonne forme. Bien que ces réponses soient dans des années, la technique de fermeture de cycle qu'ils ont découverte pourrait avoir une utilisation plus immédiate pour synthétiser des candidats médicaments. Le vaniprévir, un médicament contre l'hépatite C, qui est utilisé au Japon et dans les essais de stade avancé aux États-Unis, contient juste ce genre de grand anneau.
Le vrai potentiel des foldamers tient à leur diversité. Les chimistes peuvent fabriquer une variété presque infinie de foldamères en laboratoire, car ils ont accès à plus de blocs de construction que ceux que l'on trouve dans les protéines naturelles. Cela pourrait permettre aux chimistes de construire des catalyseurs plus utiles, ce qui a conduit Gellman à breveter certains foldamers et à fonder la société Longevity Biotech pour explorer leurs utilisations thérapeutiques.
Aller de l'avant, cette richesse d'options permettra aux chercheurs d'organiser ces catalyseurs sous des formes susceptibles d'être utiles de manière inattendue. Seules d'autres recherches le diront.
"Nous ne savons pas encore vraiment de quoi ces catalyseurs sont capables, " dit Girvin. " Il faudra des années pour comprendre leur potentiel, et il est important que nous jetions un large filet et que nous gardions l'esprit ouvert sur ce que nous pouvons accomplir avec ces nouveaux outils."