
Aaron Robart, maître assistant, École de médecine WVU, Département de biochimie. Crédit :Aira Burkhart/Université de Virginie-Occidentale
Environ 70 pour cent du génome humain ne code pour rien. Lorsqu'il est transcrit en ARN (les instructions que suivent nos cellules lorsqu'elles fabriquent des protéines), la plupart du message ne contient aucune information utile. Comme l'a dit Aaron Robart, chercheur à l'Université de Virginie-Occidentale, c'est "de l'ADN indésirable".
Robart étudie comment les cellules catalysent l'élimination de ces déchets non codants pour donner un sens à l'ARN qui reste. Pour le faire, il utilisera des bactéries qui se développent dans les sources chaudes. Les National Institutes of Health lui ont accordé 1,6 million de dollars pour le projet de cinq ans.
Ses découvertes pourraient approfondir nos connaissances sur les troubles liés aux altérations de l'expression des gènes, comme le diabète et le cancer, et en révéler davantage sur l'évolution du génome humain.
Connaître nos ancêtres bactériens
"On pense que la vie sur terre est née de l'ARN catalytique, " dit Robart, professeur adjoint de biochimie à la Faculté de médecine. "Avant il y avait des protéines, avant qu'il y ait de l'ADN, avant qu'il y ait des cellules, L'ARN se repliait en complexe, structures tridimensionnelles et comprendre la chimie de la vie."
Ce processus primitif sous-tend encore aujourd'hui comment les cellules mettent de l'ordre dans l'ARN codant et non codant, si ces cellules font partie d'un être humain, une hyène, un hortensia ou une bactérie Helicobacter. En examinant comment des organismes simples accomplissent cette tâche, des scientifiques comme Robart peuvent extrapoler leurs découvertes et mieux comprendre comment des formes de vie plus complexes, y compris nous, le font, trop.
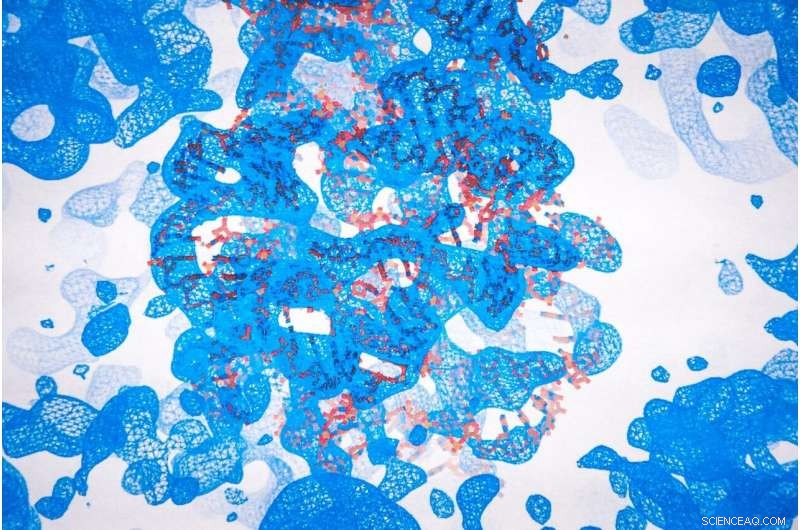
En cartographiant des structures cristallines comme celle-ci, les scientifiques peuvent mieux comprendre les processus biochimiques qui rendent la vie possible. Aaron Robart, professeur assistant au département de biochimie de la Faculté de médecine, a reçu 1,6 million de dollars des National Institutes of Health pour étudier la biochimie et la cristallographie qui sous-tendent l'épissage de l'ARN. L'ARN est le modèle de travail que les cellules suivent lorsqu'elles exécutent les instructions codées dans l'ADN. L'épissage de l'ARN forme des instructions cohérentes pour la synthèse des protéines, mais cela peut aussi conduire à des modifications néfastes de l'expression des gènes. Crédit :Aira Burkhart/Université de Virginie-Occidentale
"Dans vos cellules, L'ADN est votre copie principale. Il est transcrit en un plan de travail d'ARN, puis l'ARN est utilisé comme instructions pour fabriquer des protéines. Le seul problème est, les instructions sont quelque peu brouillées. Les exons sont des morceaux d'ARN qui se lisent comme des instructions pour fabriquer des protéines. Cependant, ils sont fréquemment interrompus par des introns non codants, ", a déclaré Robart.
Il compare le processus à un chat marchant sur votre clavier pendant que vous tapez quelque chose. Les mots que vous avez tapés sont des exons; le non-sens que votre chat "type" est des introns.
Avant même que vos cellules puissent essayer de faire ce que l'ARN leur dit de faire, ils doivent supprimer ces introns et rassembler les exons pour former un ensemble cohérent d'instructions. Une machine moléculaire élaborée appelée spliceosome effectue cette tâche, qui, chez l'homme, implique de nombreux ARN différents et des centaines de protéines.
Les introns catalytiques primitifs des bactéries fonctionnent de la même manière que notre propre machine d'épissage, quoique d'une manière moins compliquée. Ce sont les ancêtres des spliceosomes à l'œuvre dans nos propres cellules. "Vous voyez leurs empreintes digitales partout dans les machineries essentielles qui pilotent nos fonctions cellulaires. Nous utilisons ces fossiles moléculaires pour nous donner un aperçu du noyau catalytique alimentant ces machines, ", a déclaré Robart.
Un proxy improbable pour les cellules humaines :les bactéries des sources chaudes
Robart utilisera une espèce exotique, bactéries thermophiles comme modèle. L'espèce est avantageuse car elle produit des enzymes hautement actives et stables qui épissent et reconfigurent l'ARN.
"Nous avons passé environ un an et demi à tester des dizaines d'exemples différents pour trouver quelques espèces qui avaient des protéines qui pouvaient être purifiées à partir de systèmes de surexpression à des niveaux élevés, parce que nous avons besoin de beaucoup de protéines pour essayer de faire la cristallisation, " dit-il. " Nous avons découvert l'une des enzymes les plus actives de cette classe, d'une bactérie thermophile qui se développe dans les sources chaudes."
Après avoir cultivé et isolé des protéines et des ARN en grands volumes, lui et son équipe analyseront les processus biochimiques qui se produisent à l'intérieur des cellules lors de l'épissage des introns, libéré et démonté. Ils contrôleront également à distance la source de photons avancée du laboratoire national d'Argonne, qui soumettra les molécules cristallisées à une lumière ultra-brillante, rayons X à haute énergie - pour capturer des instantanés de la chimie du processus en action et en apprendre davantage sur les mécanismes moléculaires qui le sous-tendent.
Non seulement Robart et son équipe comprendront comment le spliceosome excise l'ARN non codant, mais ils discerneront également comment l'ADN indésirable se propage en l'insérant ailleurs dans le génome. C'est comme si, au lieu de supprimer le charabia que votre chat a inséré dans votre document, vous le copiez et le collez dans un tout autre paragraphe.
Ce processus, appelé rétrotransposition, peut sous-tendre diverses conditions qui découlent de mutations génétiques. "C'est une fonction motrice de l'évolution du génome et aussi de la maladie, ", a déclaré Robart. "Des mutations spontanées découlent de ces processus qui se poursuivent en nous tout le temps."
Bien que son projet ne traite pas d'une seule maladie ou d'un seul traitement, ce qu'il découvre pourrait jeter les bases du développement de thérapies à base d'ARN visant à contrôler les changements sous-jacents de l'expression des gènes observés dans de nombreuses maladies.
"Nous essayons de comprendre les fondamentaux, " a déclaré Robart. " Vous ne pouvez pas essayer de réparer quelque chose tant que vous ne comprenez pas comment cela fonctionne. "