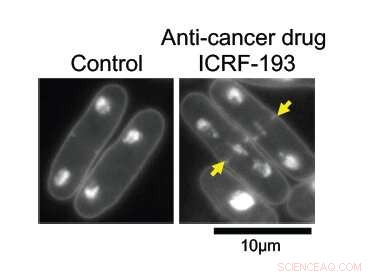
Avec l'ADN topoisomérase II (topo II) intacte, L'ADN dans les cellules de levure à fission se réplique normalement et est divisé uniformément entre deux cellules filles (à gauche). Sous les effets du médicament anticancéreux ICRF-193, l'ADN s'emmêle au centre de la cellule mère, empêchant sa division propre. Crédit :Université d'études supérieures de l'Institut des sciences et technologies d'Okinawa
Tout comme les lacets ou les colliers pendants, Les brins d'ADN peuvent s'emmêler dans des nœuds indisciplinés. Des enzymes spécialisées maintiennent l'ADN organisé lorsque les cellules se divisent, afin que les cellules se séparent en douceur et ne restent pas coincées. Mais dans les cellules tumorales, cette sécurité intégrée permet au cancer de se propager. Maintenant, des scientifiques de l'Okinawa Institute of Science and Technology Graduate University (OIST) ont appris comment ce mécanisme fonctionne dans la levure de fission et comment il pourrait être compromis dans le cancer humain.
L'étude, publié en ligne le 11 janvier 2019 par le Journal de chimie biologique , se concentre sur une cible bien établie de la thérapie anticancéreuse :l'ADN topoisomérase II, ou topo II pour faire court. Topo II régule la topologie de l'ADN, gérer l'évolution de la structure des brins au fil du temps. Les cellules cancéreuses montrent une activité topo II accrue, qui à son tour stimule la croissance tumorale. Les médicaments anticancéreux Topo II suppriment la fonction de l'enzyme, empêcher les cellules tumorales de se répliquer et d'empêcher la propagation du cancer.
Mais les médicaments topo II existants ont connu un succès limité - les scientifiques doivent en savoir plus sur le mécanisme de base avant de pouvoir l'émousser efficacement.
"De nombreux chercheurs travaillent sur le topo II, mais ils utilisent principalement des cellules humaines ou eucaryotes supérieures, " a déclaré le Dr Norihiko Nakazawa, premier auteur de l'étude et chercheur au sein de l'Unité Cellule OIST G0, dirigé par le professeur Mitsuhiro Yanagida. L'Unité a choisi d'étudier le topo II chez la levure à fission car ses mécanismes de division cellulaire sont largement conservés chez l'homme, il a dit, en plus d'être rapide et facile à manipuler.
ADN topoisomérase II (topo II), un maître régulateur du métabolisme de l'ADN pour la prolifération cellulaire, est une cible critique pour la thérapie anticancéreuse. Crédit :Université d'études supérieures de l'Institut des sciences et technologies d'Okinawa
"Nous pouvons rapidement capturer la réaction topo II dans la levure, puis passez à l'étudier dans des cellules humaines, " a déclaré Nakazawa. "Nos travaux montrent que la levure est un bon modèle pour cribler les médicaments topo II et serait une méthode rapide à utiliser dans des applications cliniques."
Augmenter l'efficacité des médicaments anticancéreux
Les chercheurs visaient à apprendre comment topo II fonctionne au niveau moléculaire. À des grossissements plus élevés, ses effets sont évidents; les cellules avec l'enzyme intacte se divisent normalement, avec la moitié de leur matériel génétique répliqué de chaque côté de la scission. Sans topo II, l'ADN reste enchevêtré au centre de la cellule mère, empêchant sa division correcte en deux cellules filles.
Des recherches antérieures suggèrent que topo II repose sur la phosphorylation, c'est-à-dire l'ajout d'un groupe phosphate à des endroits précis de sa structure. Dans la levure de fission et les cellules humaines, l'enzyme caséine kinase II, également connu sous le nom de CKII, intervient pour phosphoryler des régions spécifiques de topo II. Dans ce travail, Nakazawa a identifié ces régions et a découvert que certaines restaient phosphorylées tout au long du cycle cellulaire. Cet échange chimique constant a stimulé l'activité dans une région de topo II connue sous le nom de "domaine ATPase". Bien que les chercheurs aient observé l'amélioration, en premier, ils ne pouvaient pas dire comment cela modifiait réellement la fonction de topo II.
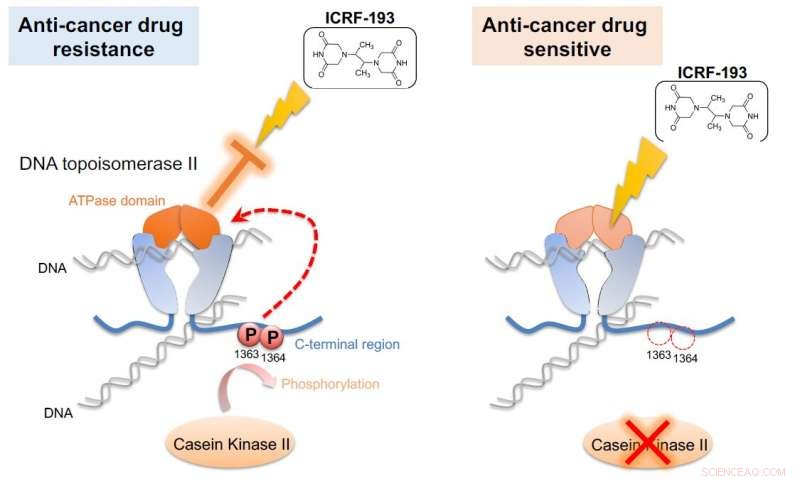
La caséine kinase II (CKII) phosphoryle l'ADN topoisomérase II (topo II), activant ainsi le domaine ATPase de l'enzyme (à gauche). Cette activation annule les effets du médicament anticancéreux ICRF-193. Si l'activité CKII est atténuée (à droite), l'efficacité de l'ICRF-193 est sauvée. L'Unité Cellulaire G0 a démontré ce mécanisme chez la levure à fission, un modèle simple qui pourrait être utilisé pour le dépistage de médicaments anticancéreux. Crédit :Université d'études supérieures de l'Institut des sciences et technologies d'Okinawa
Les scientifiques ont résolu le casse-tête en jetant un médicament topo II dans le mélange. Le médicament ICRF-193 agit en inhibant l'activité ATPase de topo II, qui piège efficacement l'ADN dans une configuration serrée afin qu'il ne puisse pas effectuer de réactions enzymatiques. Mais en présence de CKII, qui booste l'activité ATPase, le médicament est rendu inefficace.
"Cette amélioration [du domaine ATPase] a brisé l'effet du médicament anticancéreux, " dit Nakazawa. " Si nous bloquons la phosphorylation, cette activation ne se produit pas et le médicament reste efficace."
Base potentielle pour de nouvelles thérapies
Les preuves suggèrent que topo II et CKII interagissent dans les cellules humaines comme ils le font dans la levure à fission. Les cellules cancéreuses expriment des niveaux plus élevés de topo II et de CKII que les tissus normaux, et les deux enzymes ont été associées à une prolifération cellulaire anormale. Maintenant que les scientifiques comprennent le mécanisme sous-jacent de la levure, ils peuvent appliquer ces connaissances dans de futures études sur les cellules cancéreuses humaines. Un jour, la recherche peut conduire à de nouveaux traitements contre le cancer.
"Si nous inhibons CKII et topo II, cela pourrait être un moyen très efficace d'inhiber la division des cellules cancéreuses, ", a déclaré Nakazawa. "Cet effet additif pourrait être très puissant dans le traitement du cancer."