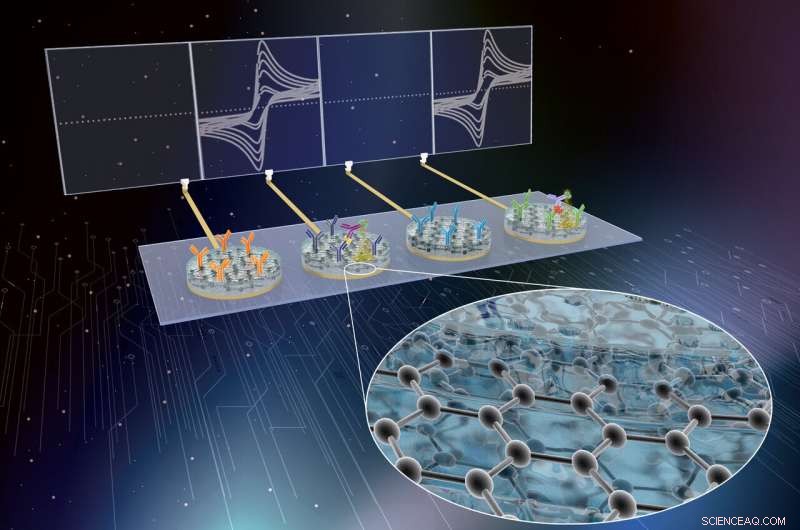
Les chercheurs du Wyss Institute ont développé la technologie eRapid en tant que plate-forme de capteurs de diagnostic électrochimique à faible coût pour la détection multiplexée de biomarqueurs de sepsis cliniquement pertinents dans le sang total. Crédit :Institut Wyss de l'Université Harvard
De nombreuses conditions médicales mettant la vie en danger, comme la septicémie, qui est déclenchée par des agents pathogènes transmissibles par le sang, ne peuvent pas être détectés avec précision et assez rapidement pour initier le bon traitement. Chez les patients qui ont été infectés par un agent pathogène inconnu et qui évoluent vers une septicémie manifeste, chaque heure supplémentaire qu'un antibiotique efficace ne peut pas être administré augmente considérablement le taux de mortalité, le temps est donc de la plus haute importance.
Le défi du diagnostic rapide du sepsis vient du fait que la mesure d'un seul biomarqueur ne permet souvent pas un diagnostic clair. Les ingénieurs ont lutté pendant des décennies pour quantifier simultanément plusieurs biomarqueurs dans le sang total avec une spécificité et une sensibilité élevées pour les applications de diagnostic au point de service (POC), car cela éviterait des étapes de traitement du sang longues et coûteuses au cours desquelles des molécules de biomarqueurs informatives pourraient potentiellement être perdues. .
Maintenant, une équipe multidisciplinaire du Wyss Institute for Biologically Inspired Engineering de Harvard et de l'Université de Bath, ROYAUME-UNI, dirigé par le directeur fondateur de Wyss, Donald Ingber, MARYLAND., Doctorat., et Pawan Jolly, scientifique principal de Wyss, Doctorat., a développé la technologie eRapid de l'Institut en tant que solution affinitaire, plate-forme de capteurs de diagnostic électrochimique à faible coût pour la détection multiplexée de biomarqueurs cliniquement pertinents dans le sang total. L'appareil utilise un nouveau revêtement de surface à base de nanocomposite de graphène et il a été démontré qu'il détecte avec précision trois biomarqueurs de sepsis différents simultanément. Les résultats sont rapportés dans Matériaux fonctionnels avancés .
"Dans cette étude, nous avons franchi une étape importante vers le déploiement de notre plate-forme de capteurs électrochimiques en milieu clinique pour une détection rapide et sensible de plusieurs analytes dans le sang total humain. Comme le revêtement nanocomposite que nous avons développé ici est peu coûteux, il a le potentiel de révolutionner les diagnostics au point de service non seulement pour tester les biomarqueurs de la septicémie, mais une gamme beaucoup plus large de biomarqueurs qui peuvent être multiplexés en ensembles pour rendre compte de l'état de nombreuses maladies et affections, " dit Ingber, qui est également responsable de la plate-forme thérapeutique et diagnostique bioinspirée du Wyss Institute, et le professeur Judah Folkman de biologie vasculaire à la Harvard Medical School et au Boston Children's Hospital, et professeur de bio-ingénierie à SEAS.
Ingber, Jolly et leur équipe Wyss développent également actuellement des capteurs électrochimiques eRapid avec le nouveau revêtement nanocomposite à base de graphène en tant que composant essentiel d'un diagnostic au point de service pour COVID, lésion cérébrale traumatique, infarctus du myocarde, et bien d'autres troubles.
En développant leur technologie de détection électrochimique du sepsis, L'équipe d'Ingber s'est appuyée sur des travaux antérieurs publiés dans Nature Nanotechnologie , dans lequel ils avaient résolu le problème du « biofouling » avec des éléments de détection électrochimiques avec leur technologie eRapid. En théorie, les biocapteurs électrochimiques seraient préférés pour de nombreuses applications cliniques en raison de leur capacité à quantifier le contenu d'échantillons biologiques en convertissant directement l'événement de liaison d'un biomarqueur en un signal électronique, leur faible consommation électrique et leur faible coût, et une intégration facile avec les lecteurs de diagnostic. Cependant, surtout lors de l'utilisation de sang total, de nombreux composants sanguins se lient de manière non spécifique aux revêtements de surface des électrodes des capteurs et conduisent à leur dégradation, ainsi que du bruit électrique sous forme de faux signaux.
La technologie eRapid de l'équipe utilise un nouveau revêtement nanocomposite antisalissure pour les électrodes auquel sont attachés des réactifs de liaison qui capturent les molécules biomarqueurs de petites quantités de sang et d'autres fluides biologiques complexes. Lors de la détection chimique de l'une de ces molécules biomarqueurs avec une sensibilité et une sélectivité élevées, la plate-forme eRapid génère un signal électrique au niveau des électrodes dont la force est corrélée avec les niveaux de molécules cibles détectées. Le revêtement nanocomposite initial a permis une excellente conversion des signaux chimiques en signaux électriques, et s'est appuyé sur de minuscules nanofils d'or électriquement conducteurs qui étaient intégrés dans une matrice d'une protéine réticulée connue sous le nom d'albumine de sérum bovin. Cependant, les coûts élevés des matériaux en or ont été le principal obstacle à la commercialisation d'eRapid pour des applications cliniques.
"Dans notre version eRapid avancée, nous avons remplacé les nanofils d'or du revêtement par des nanoflocons d'oxyde de graphène qui ont également des propriétés anti-fouling et électrochimiques, mais ils sont beaucoup moins chers et permettent des mesures encore plus sensibles. En réalité, les coûts de fabrication du nanocomposite ont été réduits à une fraction de son coût d'origine, qui, avec la vitesse de la technologie de détection, Efficacité, et la polyvalence doivent permettre à la plateforme eRapid d'avoir un impact commercial immédiat, " dit Joli.
Après avoir optimisé et caractérisé leur revêtement nanocomposite dans des tests de liaison de la cytokine inflammatoire interleukine 6, l'équipe l'a appliqué au diagnostic du sepsis. Essentiellement, en fixant une molécule d'anticorps au revêtement qui lie la procalcitonine (PCT), et ajouter un second anticorps spécifique de PCT au complexe qui est lié à une enzyme, un précipité se forme à partir d'un substrat chimique et se dépose sur le revêtement. Cela modifie le courant d'électrons atteignant l'électrode, et aide à enregistrer l'événement de liaison PCT en tant que signal électronique.
« Nous avons démontré que cet élément de capteur électrochimique peut détecter la PCT avec une grande précision dans le sang total, et l'a validé en quantifiant les niveaux de PCT dans 21 échantillons cliniques, en le comparant directement avec un test ELISA conventionnel - avec une excellente corrélation, " a déclaré le premier auteur Uroš Zupančič, qui était un chercheur invité dans le groupe d'Ingber de l'Université de Bath. Zupančič est titulaire d'un doctorat. candidat encadré par les co-auteurs de l'étude Despina Moschou, Doctorat., Maître de conférences à l'Université de Bath, et Pedro Estrela, Doctorat., Professeur agrégé et responsable du Center for Biosensors, Bioélectronique et Biodispositifs à l'Université.
L'équipe a ensuite étendu son approche à la détection simultanée de plusieurs biomarqueurs de sepsis en concevant également des éléments de capteur pour la protéine C-réactive, un autre biomarqueur du sepsis, et les modèles moléculaires associés aux agents pathogènes (PAMP). L'élément de capteur PAMP en particulier exploite la technologie de capture d'agents pathogènes à large spectre du Wyss Institute qui utilise une protéine génétiquement modifiée appelée FcMBL, qui lie plus de 100 agents pathogènes différents de toutes les classes, ainsi que des molécules à leur surface qui sont libérées dans le sang lorsque les agents pathogènes sont tués (PAMP) et agissent pour déclencher la cascade de la septicémie.
« L'assemblage de trois éléments de capteur électrochimiques dédiés pour les biomarqueurs qui peuvent être présents dans le sang à des concentrations très différentes sur une seule puce a posé un défi important. Cependant, les trois éléments du capteur final ont présenté des réponses spécifiques dans la plage cliniquement significative sans interférer les uns avec les autres, et ils l'ont fait avec un délai d'exécution de 51 minutes, qui répond au besoin clinique de diagnostic du sepsis dans la première heure, " a déclaré Zumpančič.
Pour rendre la technologie eRapid actuelle encore plus efficace et utile pour l'analyse d'échantillons cliniques, l'équipe l'a intégré à un système microfluidique qui supprime l'élément humain impliqué dans la manipulation du capteur en laboratoire, et augmente le nombre d'événements de liaison de biomarqueurs à sa surface. Cela permet d'automatiser l'analyse des biomarqueurs avec le système, et a permis aux chercheurs de réduire le délai de mesure du PCT à 7 minutes.