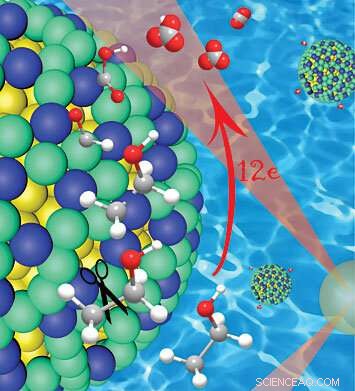
Un gros plan de la coque platine/iridium (vert/bleu) sur un noyau de nanoparticules d'or (jaune), montrant comment ce catalyseur clive les liaisons carbone-carbone (gris) dans l'éthanol tout en laissant initialement des atomes d'hydrogène attachés. L'hydrogène protège le carbone dans les premiers stades de la réaction, empêcher la formation de monoxyde de carbone empoisonnant le catalyseur, qui permet une oxydation complète et la libération de 12 électrons. Crédit :Laboratoire national de Brookhaven
Des scientifiques du laboratoire national de Brookhaven du Département de l'énergie des États-Unis (DOE) et de l'Université de l'Arkansas ont mis au point un catalyseur très efficace pour extraire l'énergie électrique de l'éthanol, un carburant liquide facile à stocker qui peut être généré à partir de ressources renouvelables. Le catalyseur, décrit dans le Journal de l'American Chemical Society , dirige l'électro-oxydation de l'éthanol vers une voie chimique idéale qui libère tout le potentiel d'énergie stockée du carburant liquide.
« Ce catalyseur change la donne qui permettra l'utilisation de piles à combustible à l'éthanol comme source prometteuse d'énergie électrique « hors réseau » à haute densité énergétique, " a déclaré Jia Wang, le chimiste du Brookhaven Lab qui a dirigé les travaux. Une application particulièrement prometteuse :les drones à pile à combustible liquide.
« Les piles à combustible à l'éthanol sont légères par rapport aux batteries. Elles fourniraient une puissance suffisante pour faire fonctionner des drones en utilisant un carburant liquide facile à remplir entre les vols, même dans des endroits éloignés, " a noté Wang.
Une grande partie de la puissance potentielle de l'éthanol est emprisonnée dans les liaisons carbone-carbone qui forment l'épine dorsale de la molécule. Le catalyseur développé par le groupe de Wang révèle que rompre ces liens au bon moment est la clé pour débloquer cette énergie stockée.
"L'électro-oxydation de l'éthanol peut produire 12 électrons par molécule, ", a déclaré Wang. "Mais la réaction peut progresser en suivant de nombreuses voies différentes."
La plupart de ces voies aboutissent à une oxydation incomplète :les catalyseurs laissent intactes les liaisons carbone-carbone, libérant moins d'électrons. Ils éliminent également les atomes d'hydrogène au début du processus, exposer des atomes de carbone à la formation de monoxyde de carbone, qui « empoisonne » la capacité des catalyseurs à fonctionner dans le temps.

Brookhaven Lab membres de l'équipe de recherche qui a développé et caractérisé un nouveau catalyseur core-shell pour l'électro-oxydation complète de l'éthanol (de gauche à droite) :Radoslav Adzic, Zhixiu Liang, Jia Wang, Eli Stavitski, et Liang Song. Crédit :Laboratoire national de Brookhaven
"L'oxydation complète à 12 électrons de l'éthanol nécessite de rompre la liaison carbone-carbone au début du processus, alors que les atomes d'hydrogène sont encore attachés, car l'hydrogène protège le carbone et empêche la formation de monoxyde de carbone, " dit Wang. Puis, plusieurs étapes de déshydrogénation et d'oxydation sont nécessaires pour achever le processus.
Le nouveau catalyseur, qui combine des éléments réactifs dans une structure noyau-enveloppe unique que les scientifiques de Brookhaven ont explorée pour une gamme de réactions catalytiques, accélère toutes ces étapes.
Pour faire le catalyseur, Jingyi Chen de l'Université de l'Arkansas, qui était un scientifique invité à Brookhaven pendant une partie de ce projet, a développé une méthode de synthèse pour co-dépôt du platine et de l'iridium sur des nanoparticules d'or. Le platine et l'iridium forment des « îlots monoatomiques » à la surface des nanoparticules d'or. Cet arrangement, Chen a noté, est la clé qui explique les performances exceptionnelles du catalyseur.
"Les noyaux de nanoparticules d'or induisent une contrainte de traction dans les îlots monoatomiques de platine-iridium, ce qui augmente la capacité de ces éléments à cliver les liaisons carbone-carbone, puis enlever ses atomes d'hydrogène, " elle a dit.
Zhixiu Liang, un étudiant diplômé de l'Université Stony Brook et le premier auteur de l'article, effectué des études dans le laboratoire de Wang pour comprendre comment le catalyseur atteint son efficacité de conversion énergétique record. Il a utilisé la "spectroscopie infrarouge de réflexion-absorption in situ" pour identifier les intermédiaires et les produits de réaction, comparer celles produites par le nouveau catalyseur avec des réactions utilisant un catalyseur à noyau d'or/enveloppe de platine et également un catalyseur d'alliage de platine-iridium.

Un schéma montrant comment les "îlots monoatomiques" de platine (vert) et d'iridium (bleu) sur la surface des nanoparticules d'or (jaune) permettent une oxydation complète de 12 électrons de l'éthanol sans empoisonnement au monoxyde de carbone. Le graphique illustre le courant de crête considérablement plus élevé produit par le nouveau catalyseur (Au@PtIr) par rapport à trois autres catalyseurs :noyau d'or/enveloppe d'iridium (Au@Ir); alliage iridium/platine (IrPt); et noyau d'or/coquille de platine (Au@Pt). Crédit :Laboratoire national de Brookhaven
"En mesurant les spectres produits lorsque la lumière infrarouge est absorbée à différentes étapes de la réaction, cette méthode nous permet de suivre, à chaque étape, quelles espèces se sont formées et quelle quantité de chaque produit, " a déclaré Liang. " Les spectres ont révélé que le nouveau catalyseur dirige l'éthanol vers la voie d'oxydation complète à 12 électrons, libérant tout le potentiel d'énergie stockée du carburant."
L'étape suivante, Wang a noté, est de concevoir des dispositifs qui incorporent le nouveau catalyseur.
Les détails mécanistiques révélés par cette étude peuvent également aider à guider la conception rationnelle de futurs catalyseurs multi-composants pour d'autres applications.