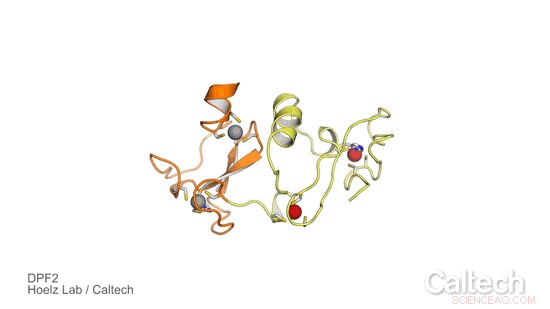
Une structure cristalline d'une partie du DPF2 humain, une protéine qui contrôle un commutateur génétique qui indique aux cellules souches du sang quand devenir des globules rouges et blancs. Les régions orange et jaune illustrent le domaine « lecteur » DPF2, qui est stabilisé par des ions zinc, représenté par des sphères rouges et grises. Crédit :Hoelz Lab/Caltech
Beaucoup de choses vont mal dans les cellules pendant le développement du cancer. Au cœur du chaos se trouvent souvent des commutateurs génétiques qui contrôlent la production de nouvelles cellules. Dans une forme particulièrement agressive de leucémie, appelée leucémie myéloïde aiguë, un commutateur génétique qui régule la maturation des cellules souches sanguines en globules rouges et blancs tourne mal. Normalement, ce changement conduit à un nombre approprié de globules blancs et rouges. Mais les patients atteints de leucémie myéloïde aiguë se retrouvent avec une accumulation dangereuse de cellules souches sanguines et un manque de globules rouges et blancs, des cellules nécessaires pour approvisionner le corps en oxygène et combattre les infections.
Maintenant, des chercheurs de Caltech et du Sylvester Comprehensive Cancer Center de l'Université de Miami se concentrent sur une protéine qui aide à contrôler ce commutateur génétique. Chez les individus sains, la protéine, appelé DPF2, arrête la production de globules rouges et blancs lorsqu'ils n'ont pas besoin d'être remplacés. C'est-à-dire, il éteint l'interrupteur. Mais la protéine peut être surproduite chez les patients atteints de leucémie myéloïde aiguë. La protéine se trouve essentiellement sur l'interrupteur, l'empêchant de se rallumer pour fabriquer les cellules sanguines au besoin. Les patients qui produisent trop de DPF2 ont un pronostic particulièrement sombre.
Dans une nouvelle étude, à paraître la semaine du 22 mai, 2017, dans la revue Actes de l'Académie nationale des sciences , les chercheurs démontrent de nouvelles façons d'empêcher le DPF2, rendant potentiellement la leucémie myéloïde aiguë plus traitable. Ils rapportent de nouveaux détails structurels et fonctionnels sur un fragment de DPF2. Cette nouvelle information révèle des cibles pour le développement de médicaments qui bloqueraient la fonction de la protéine.
« De nombreuses maladies humaines, y compris les cancers, surviennent à cause de commutateurs génétiques défectueux, " dit André Hoelz, l'auteur correspondant de l'étude. Hoelz est professeur de chimie à Caltech, un chercheur du Heritage Medical Research Institute (HMRI), et un boursier de la faculté du Howard Hughes Medical Institute (HHMI). "Élucider comment ils fonctionnent au niveau des détails atomiques nous permet de commencer le processus de personnalisation des médicaments pour les inactiver et, dans de nombreux cas, c'est une étape importante vers un remède."
Les globules rouges et blancs sont constamment régénérés à partir de cellules souches sanguines, qui résident dans notre moelle osseuse. Comme les autres cellules souches, les cellules souches du sang peuvent vivre éternellement. Ce n'est que lorsqu'elles se différencient en types cellulaires spécifiques, tels que les globules rouges et blancs, qu'ils deviennent alors mortels, ou acquérir la capacité de mourir après une certaine période de temps.
"Notre corps utilise une série complexe de commutateurs génétiques pour différencier une cellule souche sanguine en de nombreux types de cellules différents. Ces cellules différenciées circulent ensuite dans le sang et remplissent diverses fonctions. Lorsque ces cellules atteignent la fin de leur durée de vie, elles doivent Est remis, remplacé, " dit Hoelz. " C'est un peu comme remplacer les pneus usagés d'une voiture. "
Pour étudier le rôle du DPF2 et en savoir plus sur la façon dont il contrôle le commutateur génétique pour la fabrication des cellules sanguines, le groupe Hoelz s'est associé à Stephen D. Nimer, auteur co-correspondant de l'article et directeur du Sylvester Comprehensive Cancer Center, et son équipe. D'abord, Ferdinand Huber et Andrew Davenport, tous deux étudiants diplômés de Caltech dans le groupe Hoelz et co-premiers auteurs de la nouvelle étude, ont obtenu des cristaux d'une partie de la protéine DPF2 contenant un domaine connu sous le nom de doigt PHD, qui signifie planète homéodomaine. Ils ont ensuite utilisé la cristallographie aux rayons X, un processus qui consiste à exposer des cristaux de protéines à des rayons X à haute énergie, pour résoudre la structure du domaine du doigt PHD. La technique a été réalisée à la source lumineuse de rayonnement synchrotron de Stanford, en utilisant une ligne de lumière dédiée de l'Observatoire moléculaire de Caltech.
Les résultats ont révélé comment le DPF2 se lie à un complexe ADN-protéine, appelé nucléosome, pour bloquer la production de globules rouges et blancs. La protéine « lit » divers signaux affichés à la surface du nucléosome en adoptant une forme qui s'adapte à diverses modifications sur le complexe nucléosome, comme les différentes pièces de forme d'un puzzle. Une fois que la protéine se lie à ce locus d'ADN, Le DPF2 désactive l'interrupteur qui régule la différenciation des cellules sanguines.
L'étape suivante consistait à voir si le DPF2 pouvait être bloqué dans les cellules souches du sang humain en laboratoire. Sarah Greenblatt, associé postdoctoral dans le groupe Nimer et co-premier auteur de l'étude, utilisé les informations structurelles du groupe de Hoelz pour créer une version mutée de la protéine. Le groupe Nimer a ensuite introduit la protéine mutée dans les cellules souches du sang, et a découvert que le DPF2 muté ne pouvait plus se lier au nucléosome. En d'autres termes, Le DPF2 ne pouvait plus désactiver le commutateur de fabrication des cellules sanguines.
"Le DPF2 muté n'a pas pu se lier à des régions spécifiques du génome et n'a pas pu arrêter la différenciation des cellules souches sanguines, " dit Huber. " Reste à savoir si le DPF2 peut également être bloqué chez les patients cancéreux eux-mêmes. l'une des régions ressemblant à des pièces de puzzle identifiées dans la nouvelle étude, est une bonne cible pour les candidats médicaments.