
Sooyeon Hwang (assis), Dong Su (à gauche, debout, et Shuang Li du Brookhaven Lab's Center for Functional Nanomaterials, où ils ont utilisé des microscopes électroniques pour voir comment la structure cristalline et la nature chimique d'une électrode de batterie constituée d'un matériau d'oxyde de fer appelé magnétite évoluaient au fur et à mesure que le lithium était inséré et extrait sur 100 cycles de charge et de décharge. Crédit :Laboratoire national de Brookhaven
En raison de leur haute densité de stockage d'énergie, matériaux tels que les oxydes métalliques, sulfures, et les fluorures sont des matériaux d'électrode prometteurs pour les batteries lithium-ion des véhicules électriques et d'autres technologies. Cependant, leur capacité s'estompe très rapidement. Maintenant, des scientifiques qui étudient une électrode faite d'un matériau d'oxyde de fer peu coûteux et non toxique appelé magnétite ont proposé un scénario, décrit dans le numéro en ligne du 20 mai de Communication Nature - ça explique pourquoi.
"Magnétite, parmi d'autres matériaux d'électrode de type conversion (c'est-à-dire, matériaux qui se transforment en produits entièrement nouveaux lorsqu'ils réagissent avec le lithium), peuvent stocker plus d'énergie que les matériaux d'électrode d'aujourd'hui car ils peuvent accueillir plus d'ions lithium, " a déclaré le responsable de l'étude Dong Su, chef du groupe de microscopie électronique au Center for Functional Nanomaterials (CFN) - une installation utilisateur du bureau des sciences du département américain de l'Énergie (DOE) au Brookhaven National Laboratory. "Toutefois, la capacité de ces matériaux se dégrade très rapidement et dépend de la densité de courant. Par exemple, nos tests électrochimiques sur la magnétite ont révélé que sa capacité chute très rapidement au cours des 10 premiers cycles de charge et de décharge à haut débit."
Pour découvrir ce qui se cache derrière cette mauvaise stabilité en cyclisme, les scientifiques ont caractérisé l'évolution de la structure cristalline et de la nature chimique de la magnétite au fur et à mesure que la batterie effectuait 100 cycles. Pour ces études de caractérisation, ils ont combiné la microscopie électronique à transmission (MET) au CFN et la spectroscopie d'absorption des rayons X synchrotron (XAS) à l'Advanced Photon Source (APS) - une installation utilisateur du DOE Office of Science au Argonne National Lab. En TEM, un faisceau d'électrons est transmis à travers un échantillon pour produire une image ou un motif de diffraction caractéristique de la structure du matériau; XAS utilise plutôt un faisceau de rayons X pour sonder la chimie du matériau.
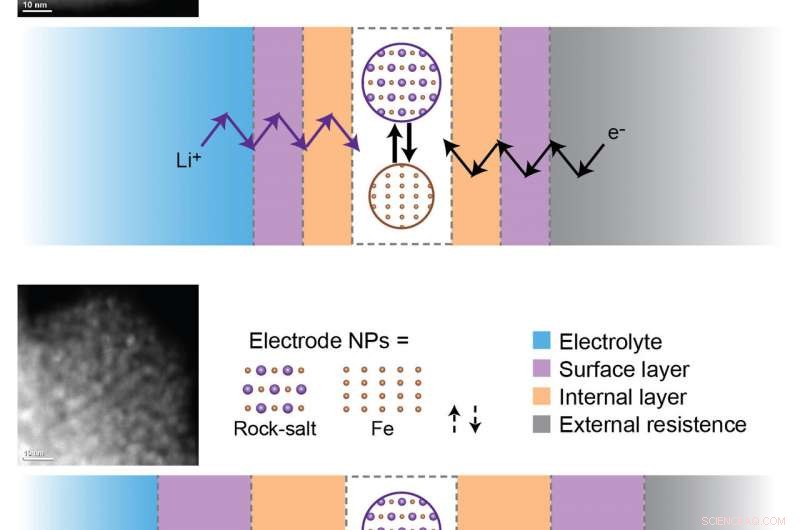
L'affaiblissement de la capacité de la batterie est dû à la formation et à l'épaississement de couches de passivation internes et de surface pendant les cycles de charge et de décharge. Pour que les réactions électrochimiques se produisent, les ions lithium (Li+) et les électrons (e-) doivent traverser toutes ces couches pour atteindre les nanoparticules actives (NP) au niveau de l'électrode. En haut :échantillon de Fe3O4 (oxyde de fer) après trois cycles. En bas :échantillon Fe3O4 après 100 cycles. Le développement de barrières cinétiques au cours du cyclage à long terme limite les réactions électrochimiques à un point tel qu'aucune réaction de réduction-oxydation ne se produit au niveau des matériaux d'électrode après 100 cycles. Crédit :Laboratoire national de Brookhaven
En utilisant ces techniques, les scientifiques ont découvert que la magnétite se décompose complètement en nanoparticules de fer métalliques et en oxyde de lithium lors de la première décharge. Dans l'accusation suivante, cette réaction de conversion n'est pas complètement réversible :il reste des résidus de fer métallique et d'oxyde de lithium. De plus, la structure "spinelle" originale de la magnétite évolue vers une structure "sel gemme" (l'emplacement des atomes de fer n'est pas tout à fait identique dans les deux structures) à l'état chargé. Avec les cycles de charge et de décharge suivants, l'oxyde de fer du sel gemme interagit avec le lithium pour former un composite d'oxyde de lithium et de nanoparticules de fer métallique. Parce que la réaction de conversion n'est pas entièrement réversible, ces produits résiduels s'accumulent. Les scientifiques ont également découvert que l'électrolyte (le milieu chimique qui permet aux ions lithium de circuler entre les deux électrodes) se décompose au cours des cycles ultérieurs.
"Nos études MET en temps réel sous ultravide nous ont permis de voir comment la structure de l'oxyde de fer du sel gemme change à mesure que le lithium est introduit après les cycles initiaux, " a déclaré Su. "Cette étude représente uniquement la lithiation in situ d'un échantillon précyclé. Les études in situ précédentes n'ont porté que sur les cycles de charge et de décharge initiaux. Cependant, nous devons savoir ce qui se passe sur de nombreux cycles pour concevoir des batteries plus durables, car la structure de l'électrode chargée est différente de celle de l'état primitif."
Sur la base de leurs résultats, les scientifiques ont proposé une explication pour la perte de capacité.
"Parce que l'oxyde de lithium a une faible conductivité électronique, son accumulation crée une barrière aux électrons qui font la navette entre l'électrode positive et négative de la batterie, " a expliqué le co-auteur principal Sooyeon Hwang, un scientifique du CFN Electron Microscopy Group. "Nous appelons cette barrière une couche de passivation interne. De même, la décomposition électrolytique empêche la conduction ionique en formant une couche de passivation en surface. Cette accumulation d'obstacles empêche les électrons et les ions lithium d'atteindre les matériaux d'électrode actifs, où se produisent les réactions électrochimiques."
Les scientifiques ont noté que le fonctionnement de la batterie à faible courant peut récupérer une partie de cette capacité en ralentissant le taux de charge pour fournir suffisamment de temps pour le transport des électrons; cependant, d'autres solutions sont nécessaires pour finalement résoudre le problème. Ils pensent que l'ajout d'autres éléments au matériau de l'électrode et le changement d'électrolyte pourraient améliorer la décoloration de la capacité.
"Les connaissances que nous avons acquises peuvent généralement être appliquées à d'autres composés de conversion, qui rencontrent également le même problème avec les couches de passivation internes et externes, " a déclaré l'auteur co-correspondant Zhongwei Chen, professeur à l'Université de Waterloo, Canada. "Nous espérons que cette étude pourra aider à orienter les futures recherches fondamentales sur ces matériaux d'électrode de type conversion prometteurs."