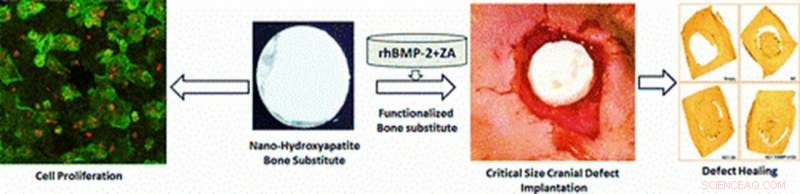
Illustration des matériaux multifonctionnels développés expérimentalement dans l'étude pour les applications in vivo de la prolifération cellulaire et de la cranioplastie. La cicatrisation du défaut dans un modèle de rongeur est observée après 12 semaines d'implantation d'échafaudage au site du défaut avec prolifération cellulaire, radiographie, analyses micro-CT et histologiques. Crédit image :ACS Applied Materials &Interfaces. Crédit: Matériaux multifonctionnels , doi :https://doi.org/10.1088/2399-7532/aafc5b
Les progrès de la science des matériaux et de la technologie de production ont permis des stratégies d'ingénierie des tissus osseux (BTE) qui génèrent des échafaudages complexes avec une architecture contrôlée pour la réparation osseuse. Les nouveaux biomatériaux peuvent être davantage fonctionnalisés avec des molécules bioactives pour la biocompatibilité en améliorant l'ostéoinductivité (induire l'ostéogenèse pour initier la cicatrisation osseuse). Dans une étude récente publiée dans Matériaux multifonctionnels, PIO Sciences , Arun Kumar Teotia et ses collègues des départements de bio-ingénierie, orthopédie, génie chimique et génie biomédical, en Inde, La Finlande et la Suède ont développé un roman, multifonctionnel, échafaudage composite bicouche (BCS). Le nouveau matériau contenait du nano-ciment céramique (NC) et l'échafaudage composite macroporeux (CG) pour imiter l'architecture osseuse pendant la réparation osseuse.
Pour fonctionnaliser les échafaudages, les scientifiques des matériaux ont ajouté la protéine morphogénétique osseuse humaine recombinante-2 (rhBMP-2) (BMP) et l'acide zolédronique (ZA). Les scientifiques ont proposé que les échafaudages composites soutiendraient la prolifération des cellules progénitrices des ostéoblastes, parallèlement à la libération contrôlée de molécules bioactives chargées pour induire la régénération osseuse. Les scientifiques de la même équipe de recherche avaient précédemment développé un matériau multifonctionnel similaire pour tester son impact initial lors d'une étude pilote in vivo.
Dans la présente étude, Teotia et al. ont observé une quantité plus élevée de tissu minéralisé (MT) avec des échafaudages fonctionnalisés dans les 12 semaines suivant l'implantation in vivo dans un groupe plus important de rats présentant des défauts crâniens critiques de 8,5 mm. Les échafaudages composites bicouches combinés (BCS) fonctionnalisés avec de l'acide zolédronique (ZA) (pour former BCS + ZA) contenaient le dépôt de MT le plus élevé (13,9 mm 3 ). Suivi de l'échafaudage composite macroporeux (CG) fonctionnalisé avec BMP et ZA (CG+BMP+ZA) à 9,2 mm 3 et BCS+ZA+BMP avec 7,6 mm 3 du dépôt de MT.
Les valeurs de MT enregistrées dans l'étude au cours de la régénération osseuse étaient significativement plus élevées que les taux d'ostéogenèse sur les échafaudages CG ou BCS non fonctionnalisés seuls (sans molécules bioactives). Les résultats ont soutenu les stratégies BTE développées dans l'étude pour former un échafaudage multifonctionnel ostéo-promotionnel qui pourrait être implanté in vivo pour réparer les défauts critiques.
Une caractéristique unique du tissu osseux est sa capacité à cicatriser sans formation de cicatrice en tant que tissu hautement dynamique avec un potentiel substantiel de régénération. La formation osseuse naturelle se produit soit via l'ossification endochondrale dans les os tubulaires (par exemple, les phalanges, fémur) ou lors du dépôt de cartilage, suivi d'une ossification. Dans un troisième processus, une ossification directe intramembraneuse peut se produire dans les os plats (crâne, bassin) sans formation de cartilage. La régénération est un processus lent dans les os plats (crâne, bassin) en raison de cellules souches mésenchymateuses (CSM) limitées, nécessitant un recrutement cellulaire important à partir du périoste ou de la dure-mère.
Par conséquent, cicatrisation des défauts de taille critique dans les os plats, comme le crâne est un défi nécessitant des stratégies BTE optimisées. Les lambeaux osseux autogreffés ont été préférés dans un premier temps pour la cranioplastie afin de minimiser les réactions immunologiques, infections et reconnaissance de corps étrangers. Après, les scientifiques ont développé des greffes osseuses vascularisées du calvaire comme choix préféré pour la reconstruction crânienne dans des études supplémentaires. Cependant, les stratégies de greffe associées ont introduit des complications lors de la résorption du matériel post-implantation et réparation, ainsi que d'autres complications cliniques au site de contact entre l'implant et l'os d'origine. La régénération et l'infiltration cellulaire dans un lambeau calvaire dépendent en grande partie des cellules progénitrices qui peuvent migrer de la dure-mère sous-jacente ou des couches péricrâniennes sus-jacentes, se différencier en cellules ostéogéniques actives pour la cicatrisation. Si la migration cellulaire est bloquée à partir des deux membranes (dure et péricrâne), la formation osseuse serait significativement plus faible.
Les scientifiques avaient déjà déterminé que les deux membranes étaient importantes pour jouer un rôle spécifique lors de la régénération, bien qu'avec l'âge le rôle du périoste dans la régénération du crâne soit moins important. Dans la présente étude, Teotia et al. ont développé l'hypothèse qu'une surface ostéoconductrice pourrait maintenir une interférence entre la dure-mère et les couches péricrâniennes pour une vascularisation précoce et un succès clinique. Pour y parvenir, ils ont généré une architecture d'échafaudage bicouche qui a intégré un nano-ciment céramique biphasique résorbable nano-hydroxyapatite-sulfate de calcium (NC) dans la couche supérieure et un cryogel poreux composite soie-bioverre-hydroxyapatite (CG) comme couche sous-jacente.
Teotia et al. a utilisé la conception bicouche pour intégrer la résistance mécanique du NC en tant que couche supérieure protectrice et la couche composite poreuse CG en tant que surface pour la fixation des cellules, infiltration, prolifération et vascularisation. Les scientifiques s'attendaient à ce que les surfaces conçues maintiennent la communication entre la dure-mère sous-jacente et les membranes périostées sus-jacentes. Ils ont fonctionnalisé les nouveaux matériaux et les ont implantés in vivo chez des rats Wistar présentant des défauts crâniens critiques pour évaluer l'effet de l'architecture poreuse bicouche sur l'ostéoconduction et la formation osseuse en préclinique, études translationnelles.
Lors de la fabrication des matériaux, les scientifiques ont moulé le NC dans une architecture de forme concave-convexe pour correspondre à la forme du crâne et lui ont permis de prendre, pour concevoir des échafaudages multicouches multifonctionnels pour la cranioplastie. Ils ont formé des disques BCS circulaires composés de NC supérieur et de CG inférieur et ont effectué des interventions chirurgicales sur des modèles animaux. Pendant la chirurgie, Teotia et al. implanter les disques d'échafaudage au site du défaut et effectuer une analyse micro-CT et radiologique ex vivo sur le calvaire excisé et récolté après sacrifice des modèles animaux, 12 semaines après l'implantation du disque.
Les scientifiques ont effectué des analyses radiologiques de la formation osseuse au site du défaut pour observer la formation de tissus ossifiés, en utilisant le scanner in vivo nanoScan pour les projections radiographiques du défaut. Ils ont utilisé l'analyse micro-CT pour détecter la formation de tissu hautement minéralisé (MT) et étudier le remplissage du défaut circulaire de 8,5 mm induit chirurgicalement (région d'intérêt). A 12 semaines, la minéralisation n'a pas atteint une fermeture parfaite dans le modèle animal. Les scientifiques ont utilisé un logiciel de quantification d'images pour montrer la plus grande quantité de formation de tissus minéralisés dans le groupe BCS+ZA, suivi du groupe CG+ZA+BMP, suivis des groupes CG+ZA+BMP et BCS+ZA+BMP.
Post-récolte, les scientifiques ont fixé les échantillons de crâne pour l'analyse histologique et ont effectué la coloration à l'hématoxyline et à l'éosine (H&E) et au trichrome de Masson des calvaires de rat. Ils ont montré que l'échafaudage composite poreux (CG) et l'échafaudage bicouche (NC+GC) (BCS) s'intégraient bien à l'os existant au site du défaut. Les échafaudages ont fourni des surfaces poreuses pour une infiltration cellulaire approfondie. Teotia et al. ont également montré que les échafaudages fonctionnalisés avaient une formation de MT systématiquement plus élevée via des tests histologiques en raison de la présence de facteurs ostéoconducteurs et ostéoinducteurs dans le composite de molécules bioactives par rapport aux groupes non fonctionnalisés. Les résultats histologiques étaient cohérents avec les résultats micro-CT de l'étude.
De cette façon, Teotia et al. ont montré que les échafaudages composites multifonctionnels pouvaient remplacer les auto ou allogreffes de grande taille, défauts osseux dans le crâne. Ils ont montré que les matériaux multifonctionnels étaient capables d'induire une vascularisation précoce et d'améliorer la minéralisation in vivo. Comme prévu, les échafaudages composites ont permis une communication ostéoconductrice poreuse entre l'infiltration cellulaire précoce du périoste et les couches de la dure-mère sous-jacentes pendant la formation osseuse rapide. Les matériaux multifonctionnels promettent d'améliorer la minéralisation osseuse et la cicatrisation précoce des défauts après l'implantation. Teotia et al. proposent de mener des études supplémentaires dans de grands modèles animaux précliniques pour optimiser et traduire le nouveau biomatériau pour des applications cliniques.
© 2019 Réseau Science X