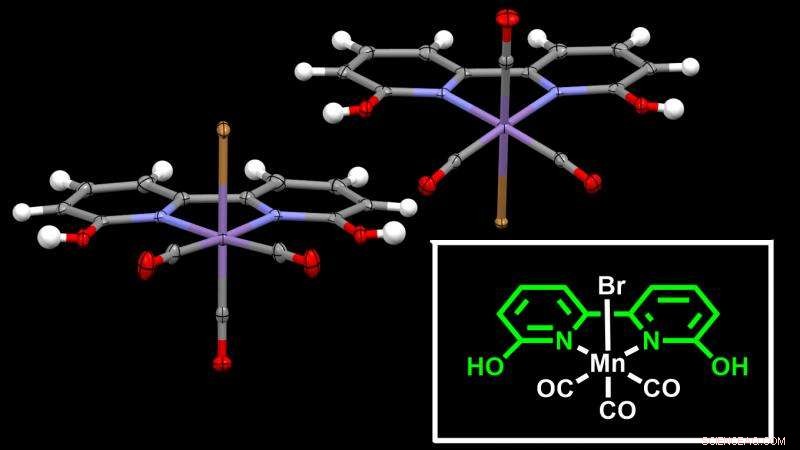
Structure cristalline du catalyseur à base de manganèse rapportée dans l'étude. L'atome de manganèse (en violet) est au centre du cadre – le ligand – qui facilite l'hydrogénation du CO2. Crédit : Institut des sciences et technologies d'Okinawa
Les chercheurs de l'OIST ont développé des catalyseurs simples à base de manganèse abondant sur Terre pour utiliser le dioxyde de carbone pour le stockage d'énergie ou le transformer en produits chimiques utiles pour l'industrie.
Le dioxyde de carbone (CO2) est connu comme un gaz à effet de serre et joue un rôle essentiel dans le changement climatique; il n'est pas étonnant que les scientifiques aient cherché des solutions pour empêcher son rejet dans l'environnement. Cependant, comme bon marché, source de carbone facilement disponible et non toxique, au cours des dernières années, des efforts ont été déployés pour transformer le dioxyde de carbone en marchandises de valeur, ou des produits à « valeur ajoutée ».
Par exemple, le dioxyde de carbone permet le stockage d'énergie en réagissant avec l'hydrogène gazeux - appelé processus d'hydrogénation - en transformant le mélange en composés liquides à plus haute énergie tels que le méthanol qui peuvent être facilement transportés et utilisés comme carburant pour les voitures. De la même manière, l'hydrogénation du dioxyde de carbone en présence d'autres produits chimiques peut conduire à la formation de divers produits à valeur ajoutée largement utilisés dans l'industrie tels que l'acide formique, formamides, ou formaldéhyde. Ces produits chimiques peuvent également potentiellement être utilisés pour le stockage d'énergie comme, par exemple, le chauffage de l'acide formique dans certaines conditions permet la libération d'hydrogène gazeux de manière contrôlée et réversible.
La conversion du dioxyde de carbone en produits utiles est compliquée par le fait que le CO2 est la forme de carbone la plus oxydée et, en tant que telle, une molécule très stable et non réactive. Par conséquent, la réaction directe du CO2 avec l'hydrogène nécessite une énergie élevée, rendant le procédé économiquement défavorable. Ce problème peut être surmonté en utilisant des catalyseurs, qui sont des composés utilisés en petites quantités pour accélérer les réactions chimiques. Pour l'hydrogénation du CO2, les catalyseurs les plus connus sont à base de métaux précieux tels que l'iridium, rhodium ou ruthénium. Bien que d'excellents catalyseurs, la rareté de ces métaux précieux rend difficile leur utilisation à l'échelle industrielle. Ils sont également difficiles à recycler et potentiellement toxiques pour l'environnement. D'autres catalyseurs utilisent des métaux moins chers tels que le fer ou le cobalt, mais nécessitent une molécule à base de phosphore - appelée phosphine - entourant le métal. Les phosphines ne sont pas toujours stables autour de l'oxygène et brûlent parfois violemment dans une atmosphère d'air, ce qui pose un autre problème pour les applications pratiques.
Pour surmonter ces problèmes, l'unité de coordination de chimie et de catalyse de l'OIST dirigée par le professeur Julia Khusnutdinova a rapporté dans Catalyse ACS des catalyseurs nouveaux et efficaces à base d'un métal peu coûteux et abondant :le manganèse. Le manganèse est le troisième métal le plus abondant dans la croûte terrestre après le titane et le fer, et présente une toxicité beaucoup plus faible par rapport à de nombreux autres métaux utilisés dans l'hydrogénation du CO2.
Les scientifiques ont d'abord cherché l'inspiration dans le monde naturel :l'hydrogénation est une réaction qui se produit dans de nombreux organismes qui n'auraient pas accès aux métaux précieux ou aux phosphines. Ils ont observé la structure d'enzymes spécifiques - les hydrogénases - pour comprendre comment elles pouvaient accomplir l'hydrogénation à l'aide de simples, Matériaux abondants sur terre. Pour faciliter l'hydrogénation, les enzymes utilisent un arrangement « intelligent » où le cadre organique environnant coopère avec un atome de métal – comme le fer – pour démarrer efficacement la réaction.
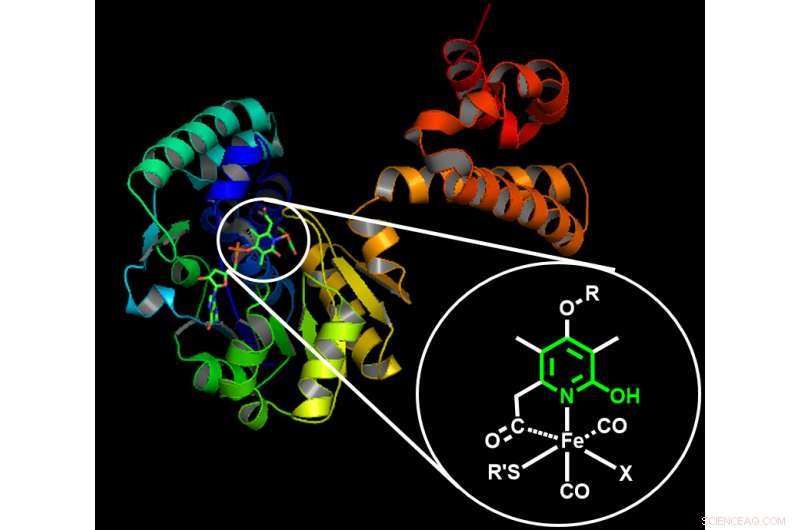
Structure d'une hydrogénase naturelle à base de fer. La structure des enzymes naturelles a inspiré les scientifiques à concevoir un cadre artificiel efficace pour un catalyseur à base de manganèse. L'insert montre la structure chimique proposée responsable de l'activation de l'hydrogène. Structure d'une hydrogénase naturelle à base de fer. La structure des enzymes naturelles a inspiré les scientifiques à concevoir un cadre artificiel efficace pour un catalyseur à base de manganèse. L'insert montre la structure chimique proposée responsable de l'activation de l'hydrogène. Crédit : Institut des sciences et technologies d'Okinawa
« Après avoir examiné les hydrogénases, nous voulions vérifier si nous pouvions fabriquer des molécules artificielles qui imitent ces enzymes en utilisant le même type de matériaux courants, comme le fer et le manganèse, " a expliqué le Dr Abhishek Dubey, le premier auteur de cette étude.
Le principal défi de cette étude était de construire un cadre adéquat - appelé ligand - autour du manganèse pour induire l'hydrogénation. Les scientifiques ont proposé une structure de ligand étonnamment simple ressemblant aux enzymes hydrogénases naturelles avec une torsion des catalyseurs de phosphine typiques.
"Dans la plupart des cas, les ligands supportent le métal sans participer directement à une activation de liaison chimique. Dans notre cas, nous pensons que le ligand participe directement à la réaction, " a déclaré le Dr Dubey.
Dans la conception de ligands, la structure d'un ligand est étroitement liée à son efficacité. Le nouveau catalyseur - le ligand et le manganèse ensemble - peut effectuer plus de 6, 000 rotations dans une réaction d'hydrogénation, convertir plus de 6, 000 fois les molécules de CO2 avant de se désintégrer. Et ce nouveau ligand, le résultat d'une collaboration avec une équipe internationale comprenant le Prof. Carlo Nervi et M. Luca Nencini de l'Université de Turin en Italie et le Dr Robert Fayzullin de Russie, est simple à fabriquer et stable dans l'air.
Pour l'instant, le catalyseur est capable de transformer le dioxyde de carbone en acide formique, un agent de conservation et de bronzage alimentaire largement utilisé, et formamide, qui a des applications industrielles. Mais la polyvalence de ce catalyseur ouvre de nombreuses autres possibilités.
"Notre prochain objectif est d'utiliser des structures aussi simples, catalyseurs au manganèse bon marché pour cibler d'autres types de réactions dans lesquelles le CO2 et l'hydrogène peuvent être convertis en produits chimiques organiques utiles", a conclu le professeur Khusnutdinova.