Fig.1 Cage moléculaire initialement fermée (gauche). Les liaisons disulfure peuvent être rompues via des réactions avec des anions thiolates, entraînant la formation d'ouvertures (à droite). Crédit :Université de Kanazawa
Des chercheurs de l'Université de Kanazawa et de l'Université de Tsukuba rapportent en Chimie – Une revue européenne la synthèse d'une cage moléculaire fermée avec des zones qui peuvent être ouvertes. L'ouverture est obtenue grâce à des réactions chimiques qui brisent les unités moléculaires faisant office de fermetures.
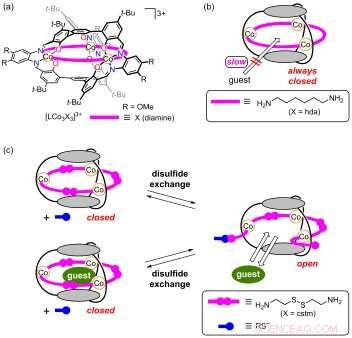
Les cages moléculaires offrent la possibilité d'encapsuler des ions ou d'autres molécules. Si la structure de la cage a une « trappe » qui peut être ouverte ou fermée de manière contrôlable, il peut fonctionner comme une porte moléculaire. Maintenant, Shigehisa Akine de l'Université de Kanazawa et ses collègues ont conçu un nouveau type de cage moléculaire avec une trappe qui s'ouvre grâce à une réaction chimique particulière :l'échange de disulfure.
La structure synthétisée par les chercheurs est une cage métallomoléculaire, impliquant trois ions cobalt liés par trois ligands cystamine. (La cystamine est un disulfure organique :la molécule comporte deux atomes de soufre liés à chacun desquels un groupe éthylamine est attaché.) Dans sa configuration telle que synthétisée, la cage est fermée.
Des études expérimentales et informatiques de la structure de la cage ont montré que les ligands de la cystamine fermaient des zones qui seraient autrement des ouvertures. Les chercheurs ont donc émis l'hypothèse que les réactions avec les anions thiolate ouvriraient ces ouvertures « bloquées », puisque les réactions d'anion disulfure-thiolate sont connues pour cliver les liaisons disulfure, et donc briser les cystamines en deux parties.
Afin de tester l'hypothèse selon laquelle les réactions avec les anions thiolates peuvent transformer la cage initialement fermée en une cage ouverte, Akine et ses collègues ont étudié l'absorption des ions césium (Cs+), car ceux-ci tiendraient en effet dans la cage ouverte.

Crédit :Chem. EUR. J.
Les scientifiques ont d'abord exposé les molécules aux ions césium en l'absence d'ions thiolate et ont surveillé les changements structurels ultérieurs au moyen de la spectroscopie de résonance magnétique nucléaire (RMN). Après environ 14 heures, une absorption de 50 pour cent de Cs+ s'était produite. Puis, la même procédure a été effectuée avec des ions thiolate présents. Déjà après une heure, une absorption de 50 pour cent de Cs+ a été observée. Le signal RMN pour la cage ouverte, cependant, n'a pas été observé, suggérant que seule une petite fraction des molécules s'était ouverte.
Des mesures supplémentaires ont confirmé que l'ion césium est bien encapsulé dans la cage fermée, et que l'anion thiolate, et non une amine également présente dans le mélange, provoque l'absorption de Cs+. Akine et ses collègues concluent que "le concept de la cage métallomoléculaire avec des fonctions d'ouverture/fermeture est considéré comme utile pour construire des conteneurs moléculaires dans lesquels un invité spécifique peut être piégé ou libéré lors d'un stimulus externe, et les systèmes d'absorption/libération d'invités à la demande seraient appliqués à de nouveaux systèmes fonctionnels avec un comportement réactif unique. »
Thiolates
Les thiolates (également appelés mercaptides) sont des sels constitués d'un contre-cation et d'un anion thiolate, qui à son tour se compose de soufre attaché à un reste organique.
Les anions thiolates réagissent avec les disulfures (deux atomes de soufre liés), rompre la liaison S-S.
Shigehisa Akine de l'Université de Kanazawa et ses collègues ont maintenant utilisé cette réaction chimique pour ouvrir un à l'origine fermé, molécule en forme de cage. Ils ont d'abord été capables de synthétiser des molécules en forme de cage avec 3 ligands de cystamine fermant les « trous » dans les molécules. Les cystamines sont des molécules symétriques avec un disulfure en son centre. Les réactions avec les anions thiolates cassent les cystamines en deux parties, ce qui conduit à la cage ayant des trous à travers lesquels des atomes ou des ions - Akine et ses collègues ont démontré l'idée avec les ions Cs + - peuvent entrer.