Les molécules d'eau liées au plus près du minéral ont un structure semblable à de la glace et ne peut pas se déplacer dans des arrangements qui permettent des réactions chimiques. Les molécules d'eau plus éloignées de la surface minérale ont un effet moins contraint, structure semblable à un liquide et peut s'organiser pour favoriser la réactivité. Crédit :Laboratoire des sciences moléculaires de l'environnement
Une équipe de chercheurs dirigée par Simone Raugei, informaticienne du PNNL, a révélé de nouvelles informations sur la façon dont cette enzyme complexe fait son travail, constatant que la formation apparemment inutile d'hydrogène a un objectif essentiel. Leur papier, "L'analyse informatique critique éclaire le mécanisme d'élimination réductrice qui active la nitrogénase pour N
La nitrogénase peut convertir l'azote en ammoniac à température ambiante et à pression atmosphérique. Industrie, d'autre part, repose sur le procédé Haber-Bosch, une technique centenaire utilisant une température et une pression élevées. Les combustibles fossiles fournissent généralement l'énergie nécessaire à ce processus, c'est pourquoi la production industrielle d'ammoniac représente à elle seule plus de 1 % des émissions mondiales totales de carbone liées à l'énergie. Comprendre ce qui confère à la nitrogénase son muscle qui brise les liaisons peut conduire à de nouvelles, idées stimulantes pour la conception de catalyseurs synthétiques pour fabriquer de l'ammoniac.
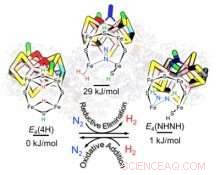
Pour chaque molécule d'azote transformée en ammoniac, la nitrogénase fabrique au moins une molécule d'hydrogène (H
Les chercheurs ont découvert que ce phénomène aide en fait la nitrogénase à lutter contre les liaisons fortes de l'azote. "La nature a trouvé une solution en couplant la production d'hydrogène, qui libère de l'énergie, avec de l'azote de clivage, qui demande de l'énergie, " a déclaré Raugei. "C'est l'équilibre total."
Pour arriver aux résultats, l'équipe a utilisé un mélange de méthodes théoriques et expérimentales. Raugei a effectué des calculs de chimie quantique sur des modèles du noyau de l'enzyme, s'appuyant sur les conseils de Seefeldt et Hoffman, experts en biochimie de la nitrogénase. Leurs données expérimentales ont aidé à éclairer les calculs, et vice versa.
Les chercheurs se sont concentrés sur le noyau catalytique de la nitrogénase, composé de fer, molybdène et soufre (FeMo-co). Au cours de l'événement catalytique, lorsque FeMo-co a acquis un nombre critique d'électrons et de protons (H+) sous forme de deux hydrures pontants (Fe-H-Fe) dans sa ceinture périphérique, génération d'un H
« Nous étions très bien placés pour réaliser cette percée car nous avons combiné les informations expérimentales sur la nitrogénase avec les informations de calcul, " dit Raugei. "C'était la clé."
Les chercheurs cherchent à étendre la recherche en examinant les détails fins de l'accumulation d'électrons et de protons sur le site actif de la nitrogénase et exactement comment le N