La table spira de Theodor Benfey (1964). Crédit :DePiep/Wikipédia
Le tableau périodique regarde depuis les murs de presque tous les laboratoires de chimie. Le mérite de sa création revient généralement à Dimitri Mendeleev, un chimiste russe qui en 1869 a écrit les éléments connus (dont il y avait 63 à l'époque) sur des cartes et les a ensuite disposés en colonnes et en rangées selon leurs propriétés chimiques et physiques. Pour célébrer le 150e anniversaire de ce moment charnière de la science, l'ONU a proclamé 2019 l'année internationale du tableau périodique.
Mais le tableau périodique n'a pas réellement commencé avec Mendeleev. Beaucoup avaient bricolé avec l'arrangement des éléments. Des décennies auparavant, le chimiste John Dalton a essayé de créer une table ainsi que des symboles assez intéressants pour les éléments (ils n'ont pas réussi). Et quelques années seulement avant que Mendeleev ne s'asseye avec son jeu de cartes maison, John Newlands a également créé un tableau triant les éléments selon leurs propriétés.
Le génie de Mendeleev était dans ce qu'il laissait de côté. Il a reconnu que certains éléments manquaient, encore à découvrir. Alors, où Dalton, Newlands et d'autres avaient exposé ce qui était connu, Mendeleev a laissé place à l'inconnu. Encore plus étonnant, il a prédit avec précision les propriétés des éléments manquants.
Remarquez les points d'interrogation dans son tableau ci-dessus ? Par exemple, à côté d'Al (aluminium) il y a de la place pour un métal inconnu. Mendeleev a prédit qu'il aurait une masse atomique de 68, une densité de six grammes par centimètre cube et un point de fusion très bas. Six ans plus tard, Paul Émile Lecoq de Boisbaudran, gallium isolé et bien sûr, il s'est inséré directement dans l'espace avec une masse atomique de 69,7, une densité de 5,9 g/cm³ et un point de fusion si bas qu'il devient liquide dans la main. Mendeleev a fait de même pour le scandium, germanium et technétium (qui n'a été découvert qu'en 1937, 30 ans après sa mort).

La liste des éléments de John Dalton. Crédit :Wikimedia Commons
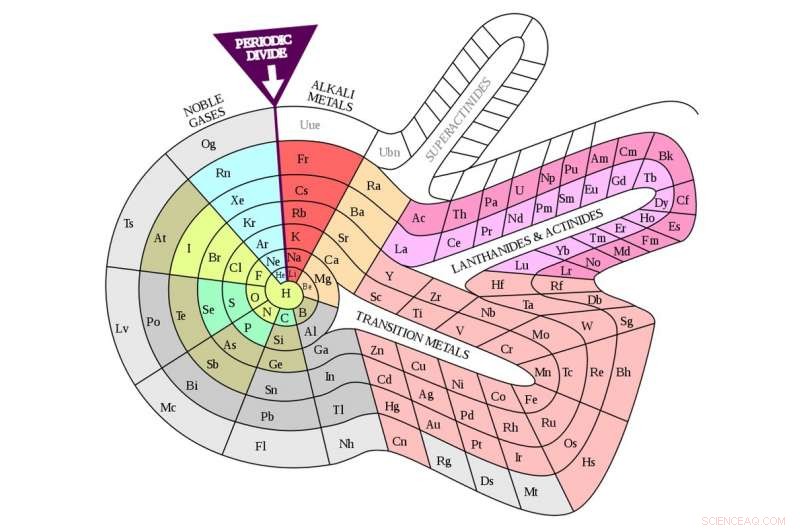
À première vue, la table de Mendeleev ne ressemble pas beaucoup à celle que nous connaissons. Pour une chose, la table moderne a un tas d'éléments que Mendeleev a négligés (et n'a pas laissé de place pour), notamment les gaz rares (tels que l'hélium, néon, argon). Et la table est orientée différemment de notre version moderne, avec des éléments que nous plaçons maintenant ensemble dans des colonnes disposées en rangées.
Mais une fois que vous faites pivoter la table de Mendeleev à 90 degrés, la similitude avec la version moderne devient évidente. Par exemple, les halogènes – fluor (F), chlore (Cl), brome (Br), et l'iode (I) (le symbole J dans le tableau de Mendeleev) – tous apparaissent côte à côte. Aujourd'hui, ils sont rangés dans la 17e colonne du tableau (ou groupe 17 comme les chimistes préfèrent l'appeler).

Le tableau de Dimitry Mendeleev complet avec des éléments manquants. Crédit :Wikimedia Commons
Période d'expérimentation
Cela peut sembler un petit saut de ceci au diagramme familier, mais, ans après les publications de Mendeleev, il y avait beaucoup d'expérimentation avec des dispositions alternatives pour les éléments. Avant même que la table n'obtienne son retournement permanent à angle droit, les gens ont suggéré des rebondissements étranges et merveilleux.
Un exemple particulièrement frappant est la spirale de Heinrich Baumhauer, publié en 1870, avec de l'hydrogène en son centre et des éléments dont la masse atomique augmente en spirale vers l'extérieur. Les éléments qui tombent sur chacun des rayons de la roue partagent des propriétés communes tout comme ceux d'une colonne (groupe) le font dans le tableau d'aujourd'hui. Il y avait aussi la formulation assez étrange de « haltères » d'Henry Basset de 1892.
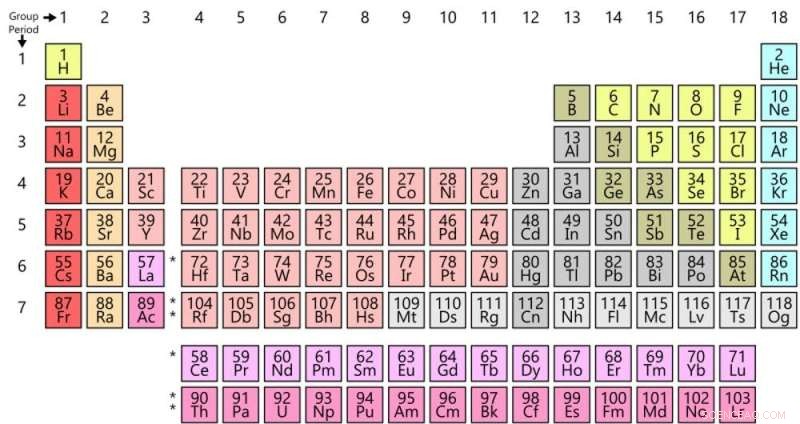
Le tableau périodique du jour. Crédit :Offnfopt/Wikipédia
Néanmoins, au début du 20e siècle, la table s'était installée dans un format horizontal familier avec la version étonnamment moderne de Heinrich Werner en 1905. Pour la première fois, les gaz rares sont apparus dans leur position désormais familière à l'extrême droite de la table. Werner a également essayé de s'inspirer du livre de Mendeleev en laissant des lacunes, bien qu'il ait plutôt exagéré le travail de conjecture avec des suggestions d'éléments plus légers que l'hydrogène et un autre situé entre l'hydrogène et l'hélium (dont aucun n'existe).
Malgré cette table à l'allure plutôt moderne, il y avait encore un peu de réaménagement à faire. La version de Charles Janet a été particulièrement influente. Il a adopté l'approche d'un physicien pour la table et a utilisé une théorie quantique récemment découverte pour créer une disposition basée sur des configurations d'électrons. Le tableau du "pas de gauche" qui en résulte est toujours préféré par de nombreux physiciens. De façon intéressante, Janet a également fourni de l'espace pour les éléments jusqu'au numéro 120 alors que seulement 92 étaient connus à l'époque (nous n'en sommes qu'au 118 maintenant).

La spirale de Heinrich Baumhauer. Réimprimé (adapté) avec la permission de Types de classifications graphiques des éléments. III. Spirale, hélicoïdal, et divers graphiques. Crédit :G.N. Quam, Mary Battell Quam. Copyright (1934) Société chimique américaine.
S'installer sur un design
La table moderne est en fait une évolution directe de la version de Janet. Les métaux alcalins (le groupe surmonté par le lithium) et les métaux alcalino-terreux (surmontés par le béryllium) se sont déplacés de l'extrême droite à l'extrême gauche pour créer un tableau périodique très large (forme longue). Le problème avec ce format est qu'il ne tient pas bien sur une page ou une affiche, donc en grande partie pour des raisons esthétiques, les éléments f-block sont généralement découpés et déposés sous la table principale. C'est ainsi que nous sommes arrivés à la table que nous reconnaissons aujourd'hui.
Cela ne veut pas dire que les gens n'ont pas bricolé les mises en page, souvent comme une tentative de mettre en évidence des corrélations entre des éléments qui ne sont pas facilement apparents dans le tableau conventionnel. Il existe littéralement des centaines de variantes (consultez la base de données de Mark Leach), les spirales et les versions 3D étant particulièrement populaires, sans parler des variantes plus ironiques.
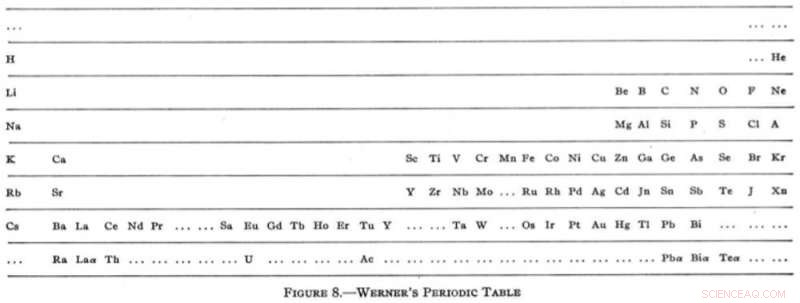
L'incarnation moderne de Heinrich Werner. Réimprimé (adapté) avec la permission de Types de classifications graphiques des éléments. I. Introduction et tables courtes, G.N. Quam, Mary Battell Quam. Crédit :Société chimique américaine (1934)
Que diriez-vous de ma propre fusion de deux graphiques emblématiques, La table de Mendeleev et le plan du métro de Londres d'Henry Beck ci-dessous ?
Ou la gamme vertigineuse d'imitations qui visent à donner une touche scientifique à tout catégoriser, de la bière aux personnages de Disney, et mon "absurdité irrationnelle" préféré en particulier. Tout cela montre comment le tableau périodique des éléments est devenu le symbole emblématique de la science.

La table de marche gauche de Charles Janet. Crédit :Wikipédia, CC BY-SA

Version 3D 'Fleur de Mendeleev' de la table. Crédits :имохова Ольга/Wikipédia, CC BY-SA
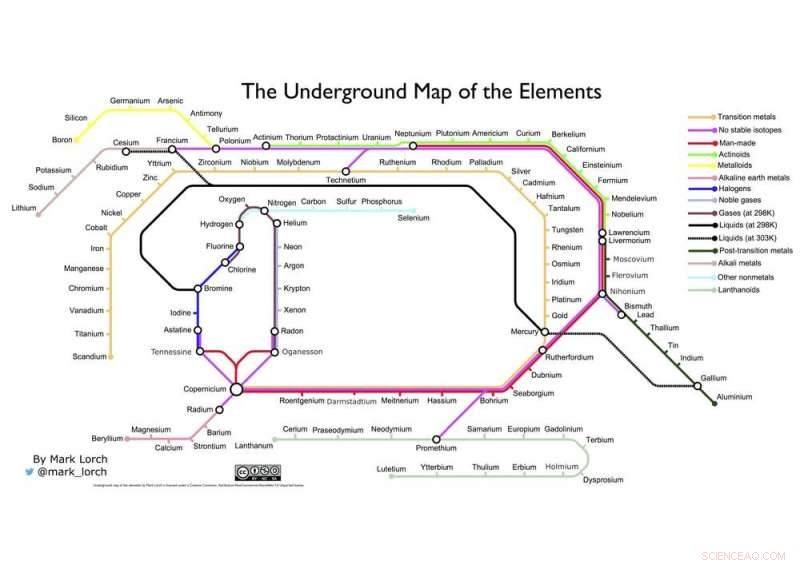
La carte souterraine des éléments de l'auteur. Crédit :Mark Lorch, Auteur fourni
Cet article est republié à partir de The Conversation sous une licence Creative Commons. Lire l'article original. 