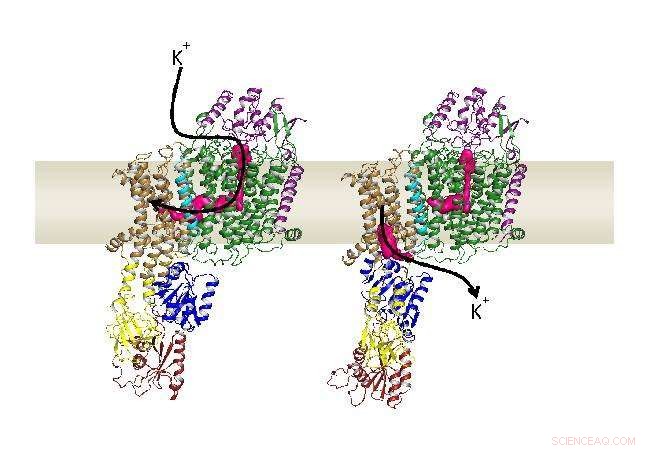
Structures d'ouverture vers l'extérieur et vers l'intérieur de KdpFABC dans la membrane cellulaire. Crédit :Groupe de recherche Inga Hänelt. Crédit :Goethe-Universität Frankfurt am Main
Depuis des décennies, on supposait que les canaux protéiques et les pompes à protéines remplissaient des fonctions complètement différentes et fonctionnaient indépendamment les uns des autres. Des chercheurs de l'université Goethe de Francfort et de l'université de Groningen ont désormais élucidé la voie de transport d'un complexe protéique qui combine les deux mécanismes :il reçoit d'abord du potassium du canal puis le transfère à la pompe, d'où il est transporté vers la cellule.
Un ménage équilibré en potassium est essentiel pour la survie des personnes et des bactéries. Comme les bactéries sont exposées à des fluctuations beaucoup plus importantes des conditions environnementales, l'apport contrôlé de potassium pose souvent un défi particulier. Puisque la membrane cellulaire est impénétrable pour les ions potassium, il doit être transloqué par des protéines de transport membranaire spécifiques.
D'un côté, les canaux potassiques permettent le rapide, mais afflux passif d'ions potassium. Celui-ci s'arrête dès qu'un équilibre électrochimique entre la cellule et son environnement est atteint. Pour atteindre des concentrations intracellulaires au-delà, le potassium est transporté activement dans la cellule par des pompes à potassium, l'énergie étant consommée sous forme d'ATP.
Puisque les deux familles de protéines – canaux et pompes – remplissent des fonctions très différentes, ils ont toujours été décrits comme séparés les uns des autres. Cette, cependant, est contredit par l'observation que KdpFABC, un très affin, système actif d'absorption de potassium des bactéries, ne représente pas une simple pompe, mais est constitué d'un total de quatre protéines différentes. L'un d'eux est dérivé d'une pompe typique, tandis qu'un autre ressemble à un canal potassique.
Inga Hanelt, Professeur assistant de biochimie à l'Université Goethe, et sa collègue Cristina Paulino de l'Université de Groningen, les Pays-Bas, a donc décidé d'examiner de plus près la protéine membranaire KdpFABC au microscope - ou, plus précisement, le cryomicroscope électronique. Ils ont été surpris par le résultat :« Toutes les hypothèses précédentes étaient fausses, " déclare Inga Hänelt. " Bien que nous ayons toutes les données sous les yeux, il nous a fallu un certain temps pour comprendre le chemin emprunté par le potassium à travers le complexe jusqu'à la cellule."
D'abord, une protéine de type canal lie le potassium et le transporte à travers le premier tunnel jusqu'à la pompe. Une fois arrivé, la première, le tunnel tourné vers l'extérieur se ferme, pendant une seconde, le tunnel orienté vers l'intérieur s'ouvre. Ce tunnel s'étend également entre les deux protéines et se termine finalement à l'intérieur de la cellule. « Le complexe combine essentiellement les meilleures qualités des deux familles de protéines, " explique Charlotte Stock, doctorante dans le groupe de recherche d'Inge Hänelt. "La protéine en forme de canal se lie au potassium, d'abord très spécifiquement et avec une grande affinité, tandis que la pompe permet un transport actif qui peut enrichir par 10 le potassium dans la cellule, 000 fois."
Les données, récemment publié dans Communication Nature , impressionné les scientifiques par la diversité du transport à travers les membranes. « Nous avons appris qu'en étudiant diverses protéines de transport membranaire, il ne faut pas se fier à des mécanismes apparemment incontournables, mais il faut être prêt pour les surprises, " résume Inga Hänelt.