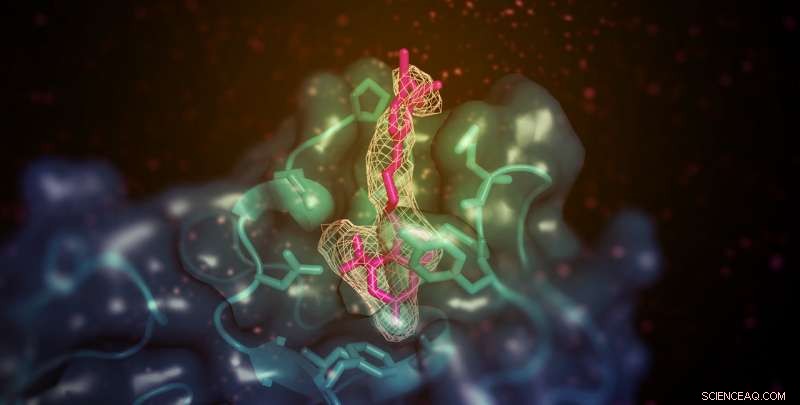
Une petite molécule (montrée ici en rose) ayant la capacité d'augmenter le « bon » cholestérol (HDL) dans les modèles animaux se lie au domaine de liaison membranaire de la lécithine:cholestérol acyltransférase (LCAT; illustré en bleu sarcelle). Le site est éloigné du site actif de l'enzyme mais permet en quelque sorte le transfert des substrats lipidiques des HDL. Crédit :Kelly Manthei et Stéphanie King
Les scientifiques ont déterminé la structure de la forme activée d'une enzyme qui aide à renvoyer l'excès de cholestérol vers le foie, une étude en eLife rapports.
La recherche révèle comment un produit chimique semblable à un médicament stimule l'action de l'enzyme lécithine:cholestérol acyltransférase (LCAT). Cela suggère également que de futurs médicaments utilisant le même mécanisme pourraient être utilisés pour restaurer la fonction LCAT chez les personnes présentant un déficit familial en LCAT (FLD), une maladie héréditaire rare qui les expose à des problèmes oculaires, anémie et insuffisance rénale.
Le LCAT aide les lipoprotéines de haute densité (HDL) - connues sous le nom de « bon » cholestérol - à éliminer le cholestérol du sang en convertissant le lipide en une forme plus facile à emballer et à transporter. Il y a plus de 90 mutations connues dans LCAT, qui peut provoquer soit une perte partielle d'activité (connue sous le nom de « maladie des yeux de poisson ») soit une perte totale (FLD). Le renforcement de l'activité LCAT pourrait donc être bénéfique dans le traitement des personnes atteintes de maladie coronarienne et de déficiences en LCAT, mais les mécanismes par lesquels il peut être activé sont mal compris.
"Dans cette étude, nous avons utilisé la biologie structurale pour comprendre comment un activateur LCAT breveté se lie à LCAT et comment il favorise le transport du cholestérol, " dit l'auteur principal Kelly Manthei, chercheur postdoctoral à l'Institut des sciences de la vie de l'Université du Michigan, NOUS. "Nous avons également demandé si le composé pouvait aider à récupérer l'activité des enzymes LCAT qui ont des mutations couramment observées dans FLD."
L'équipe a utilisé la cristallographie aux rayons X pour examiner l'enzyme LCAT stabilisée dans son état actif avec deux produits chimiques différents :la molécule activatrice, et un second composé qui imite un substrat lié à l'enzyme. Les deux produits chimiques ont eu plus d'effet sur la protéine lorsqu'ils sont présentés ensemble que lorsqu'ils sont présentés séparément, ce qui suggère qu'ils se lient à l'enzyme à différents endroits.
Une analyse plus poussée a révélé que la molécule activatrice, contrairement à d'autres activateurs LCAT connus, se lie à une région proche de l'endroit où HDL se fixe. Cependant, l'activateur n'a pas aidé LCAT à se lier plus efficacement aux HDL, ce qui a conduit l'équipe à spéculer qu'il aide plutôt à transférer le cholestérol et les lipides dans le centre catalytique de l'enzyme, afin qu'il puisse le convertir en fret pour le transport en HDL.
Ayant établi ce mode d'action, les chercheurs ont testé si cette molécule pouvait aider à récupérer la fonction de transport du cholestérol d'une enzyme LCAT mutante. Ils ont fait une version de l'enzyme avec une mutation couramment observée chez les patients FLD, puis testé sa capacité à se lier aux HDL et à convertir le cholestérol en présence ou en l'absence de la molécule activatrice. Ils étaient ravis de découvrir que l'activateur pouvait en partie inverser la perte d'activité des enzymes mutantes, résultant en une conversion comparable du cholestérol en enzyme normale.
"Nos résultats aideront les scientifiques à concevoir des composés capables de mieux cibler la LCAT afin qu'ils puissent avoir un avantage thérapeutique pour les patients atteints de maladies cardiaques et de FLD, " conclut l'auteur principal John Tesmer, Professeur Walther en biologie structurale du cancer à l'Université Purdue, NOUS. "Les efforts futurs seront d'examiner si les patients présentant d'autres mutations génétiques LCAT pourraient bénéficier des composés utilisés dans cette étude, et de concevoir des molécules avec des propriétés pharmacologiques améliorées pour un développement ultérieur."