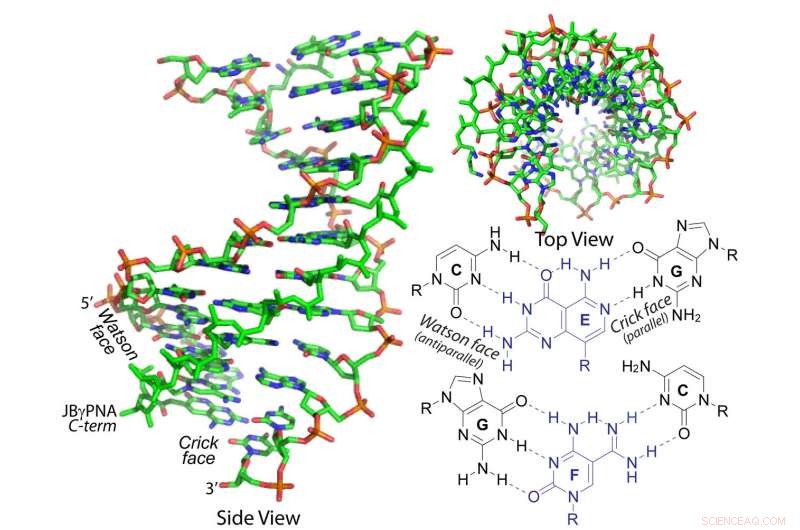
Développé par des chercheurs de l'Université Carnegie Mellon, cet acide nucléique peptidique janus gamma (PNA) peut envahir la double hélice de l'ADN et de l'ARN. Crédit :Université Carnegie Mellon
Des chercheurs de l'Université Carnegie Mellon ont développé une molécule synthétique capable de reconnaître et de se lier à l'ADN ou à l'ARN double brin dans des conditions physiologiques normales. La molécule pourrait fournir une nouvelle plate-forme pour développer des méthodes de diagnostic et de traitement des maladies génétiques. Leurs conclusions sont publiées dans Chimie des communications .
Le travail a été réalisé par une équipe internationale d'experts, dont le professeur de chimie Carnegie Mellon Danith Ly, un expert en conception d'acides nucléiques peptidiques, postdoctorant en chimie Shivaji Thadke et l'étudiante diplômée en chimie Dinithi Perera, Professeur de chimie et expert en résonance magnétique nucléaire Roberto Gil, et Arnab Mukherjee, informaticien à l'Institut indien d'enseignement et de recherche scientifiques à Pune.
"Depuis que la structure en double hélice de l'ADN a été élucidée pour la première fois par Watson et Crick, les scientifiques ont essayé de concevoir des molécules qui peuvent se lier à l'ADN et permettre de contrôler le flux d'informations génétiques, " a déclaré Ly. "C'est la première molécule bifaciale qui peut envahir l'ADN ou l'ARN double brin dans des conditions biologiquement pertinentes."
ADN, qui contient toutes les informations génétiques d'un organisme, est constitué de deux brins de nucléotides. Les nucléotides se connectent les uns aux autres en utilisant des liaisons hydrogène, formant une chaîne hélicoïdale de paires de bases Watson-Crick. Bien que ces paires de bases fournissent un code relativement simple à notre information génétique, entrer dans la double hélice pour changer le code est difficile en raison des fortes liaisons entre les paires de bases.
Ly et ses collègues de l'Institute for Biomolecular Design and Discovery (IBD) et du Center for Nucleic Acids Science and Technology (CNAST) de l'Université Carnegie Mellon sont des leaders dans la conception et le développement d'acides nucléiques gamma-peptides (gamma PNA). Analogues synthétiques de l'ADN et de l'ARN, Les gamma PNA peuvent être programmés pour se lier au matériel génétique (ADN ou ARN) qui cause la maladie, leur permettant de rechercher des séquences nuisibles et de s'y lier pour empêcher un dysfonctionnement d'un gène.
Le groupe a créé des PNA gamma double face appelés Janus gamma PNA. Nommé d'après le dieu romain à deux visages, Les PNA Janus sont capables de reconnaître et de se lier aux deux brins d'une molécule d'ADN ou d'ARN.
Le concept de reconnaissance bifaciale, qui est à la base des PNA gamma Janus, a été conçu pour la première fois il y a plus de deux décennies par Jean-Marie Lehn, un lauréat du prix Nobel connu pour ses travaux dans le domaine de la chimie supramoléculaire, et exposé par d'autres chercheurs dans le domaine.
L'avancement de cette recherche a été freiné par deux obstacles. D'abord, les chercheurs n'avaient pu fabriquer qu'un petit nombre de bases Janus, et ces bases variaient considérablement en forme et en taille. Ces limitations signifiaient que les différentes bases de Janus ne pouvaient reconnaître que les répétitions du même ensemble de paires de bases et ne pouvaient pas être utilisées ensemble comme des blocs de construction pour reconnaître des séquences plus complexes dans l'ADN ou l'ARN.
Deuxièmement, il était difficile de synthétiser des bases Janus pour des paires de bases canoniques. La nature complémentaire des deux faces des bases de Janus a fait que les molécules s'hybrident et se lient les unes aux autres, les empêchant de s'incorporer dans l'ADN et l'ARN.
Dans l'étude actuelle, Ly et ses collègues surmontent ces obstacles. Ils ont créé un tout nouvel ensemble d'éléments de reconnaissance d'acide nucléique bifacial, 16 au total, qui représentait toutes les combinaisons possibles de bases nucléiques pouvant être trouvées dans le code génétique. Les PNA gamma Janus peuvent être utilisés pour reconnaître n'importe quelle combinaison de paires de bases et mélangés et appariés pour détecter et se lier à des séquences génétiques complexes.
Thadke a résolu le problème de la synthèse chimique en concevant une nouvelle méthode de synthèse en solution et en phase solide pour développer les PNA gamma Janus. Il a également déployé une astuce inhérente à la préorganisation hélicoïdale dans le squelette du gamma PNA pour empêcher les bases Janus auto-complémentaires de s'hybrider les unes aux autres.
Ces nouveaux Janus gamma PNA ont une énergie de liaison extraordinairement élevée et sont les premiers à pouvoir envahir une double hélice d'ADN ou d'ARN à paires de bases canoniques à une force ionique et à une température physiologiquement pertinentes.
Pour ce faire, ils tirent parti du moment où les molécules d'ADN et d'ARN double brin "respirent" et les liaisons entre les paires de bases s'ouvrent pendant des fractions de seconde. Quand cela arrive, le Janus PNA s'insère entre les brins séparés. Si les paires de bases ne correspondent pas, le Janus PNA est éjecté de la molécule d'ADN. Mais s'ils correspondent, le Janus PNA se lie aux deux brins de la molécule.
Les PNA Janus gamma ont un large éventail d'utilisations biologiques et biomédicales. Ils peuvent être conçus pour cibler l'ADN génomique pour l'édition de gènes et la régulation transcriptionnelle. Ils pourraient également être conçus pour se lier de manière spécifique et sélective aux structures secondaires et tertiaires de l'ARN, quelque chose que les agents antisens traditionnels et les ligands à petites molécules ne sont pas capables de faire. Par exemple, les PNA Janus gamma pourraient être programmés pour se lier à des expansions répétées par l'ARN, ce qui pourrait conduire à de nouveaux traitements pour un certain nombre de maladies neuromusculaires et neurodégénératives, y compris la dystrophie myotonique de type 1 et la maladie de Huntington, ou aux ARN non codants, y compris l'ARN ribosomique et télomérase du pathogène, pour lutter contre les maladies génétiques et infectieuses.
La technologie est explorée par des startups ainsi que par des laboratoires pharmaceutiques pour des développements thérapeutiques.