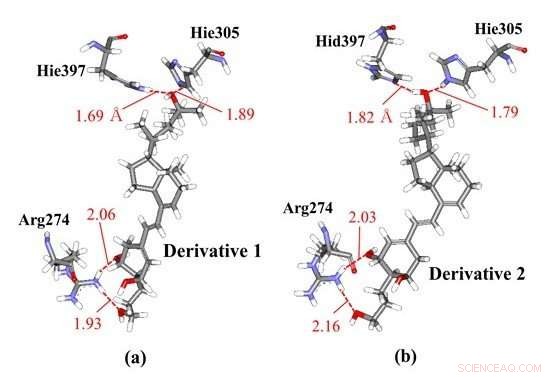
Interactions de liaison hydrogène entre les dérivés de la vitamine D et les résidus d'acides aminés dans le VDR ; (a) le dérivé 1 et (b) le dérivé 2 qui ont les mêmes structures chimiques mais des chiralités différentes. Nos simulations moléculaires ab initio ont démontré que le dérivé 1 interagit avec Hie397 et Hie305, tandis que le dérivé 2 interagit avec différents résidus histidine protonés, tels que Hid397 et Hie305, indiquant que la différence de chiralité des dérivés peut induire des changements dans les états de protonation de l'histidine de la protéine VDR. Crédit :Université de technologie de Toyohashi
Chercheurs de l'Université de technologie de Toyohashi, en coopération avec des chercheurs de Teijin Pharma Ltd. et de l'Université de Teikyo, ont mis en évidence la possibilité que la chiralité des dérivés de la vitamine D puisse affecter les états de protonation des résidus d'histidine dans la protéine réceptrice de la vitamine D via des simulations moléculaires ab initio et des analyses biomédicales. Cette découverte souligne que les états de protonation devraient être considérés plus précisément dans les simulations moléculaires, lors de l'étude d'interactions spécifiques entre les médicaments candidats et les protéines cibles liées à la pathogenèse de la maladie.
La vitamine D joue de nombreux rôles importants dans l'apparition de maladies immunologiques, ainsi que la régulation des taux de calcium dans le sang. Ces actions physiologiques provoquées par la vitamine D active sont déclenchées par l'interaction spécifique de la vitamine D active avec le récepteur de la vitamine D (VDR); de nombreux types de dérivés de la vitamine D ont été développés en tant que ligands puissants contre le VDR. Il a été rapporté que l'affinité de liaison entre le VDR humain et les dérivés de la vitamine D dépendait de manière significative de la chiralité du dérivé.
Cependant, la raison de la dépendance n'a pas été clarifiée, ce qui en fait un goulot d'étranglement dans le développement de médicaments nouveaux et puissants contre les maladies immunologiques, dont l'apparition est liée à l'activation du VDR.
Maintenant, des chercheurs du Département d'informatique et d'ingénierie de l'Université de technologie de Toyohashi et de Teijin Pharma Ltd. et de l'Université de Teikyo ont démontré la possibilité que la chiralité du dérivé de la vitamine D affecte les états de protonation des résidus d'histidine dans la protéine VDR sur la base des résultats évalué par des simulations moléculaires de pointe et l'ordinateur K de RIKEN.
Les chercheurs ont observé les interactions spécifiques entre le VDR et certains dérivés de la vitamine D avec différentes chiralités à l'aide de calculs ab initio d'orbitales moléculaires de fragments (FMO). Les résultats du FMO révèlent que deux résidus d'histidine dans le VDR contribuent de manière significative à la liaison du VDR avec les dérivés et que les états de protonation de ces résidus peuvent affecter les interactions spécifiques. Par conséquent, les chercheurs ont examiné les autres états de protonation possibles de ces résidus d'histidine et déterminé les états les plus stables à l'aide des calculs ab initio FMO. Les résultats illustrés, pour la première fois, la possibilité que la différence des chiralités des dérivés de la vitamine D puisse induire des changements dans les états de protonation des résidus d'histidine dans le VDR qui existe à proximité du dérivé. En raison de ce changement dans l'état de protonation, les dérivés peuvent se lier plus fortement au VDR et peuvent ainsi produire des complexes plus stables avec lui.
Cette découverte fournit un avertissement important et essentiel pour que les simulations moléculaires considèrent plus précisément les états de protonation des résidus d'histidine dans les protéines tout en étudiant les interactions spécifiques entre les protéines et les ligands.
"Nous avons utilisé des simulations moléculaires sophistiquées et l'ordinateur K pour découvrir que les états de protonation des résidus d'histidine dans le VDR changent de manière significative avec des altérations de la chiralité du ligand, " explique le professeur agrégé Noriyuki Kurita, "Étant donné que des résidus d'histidine existent dans de nombreuses protéines impliquées dans la pathogenèse des maladies, nous devrions considérer leurs états de protonation plus précisément via la conception de médicaments in silico basée sur des simulations moléculaires. »
Le premier auteur, étudiant diplômé Yuta Terauchi, mentionné, "Notre objectif final est de développer des médicaments nouveaux et puissants capables d'activer le VDR sur la base de nos simulations moléculaires ab initio, as well as on the basis of biomedical studies performed by our collaborators."
The authors are participating in an in silico drug design consortium—the fragment molecular orbital drug design (FMODD) consortium—in which various researchers from universities, drug companies, and national institutes are investigating the specific interactions between disease-related proteins and many types of candidate drugs using ab initio molecular simulations based on the FMO method and the K computer. Similar molecular simulations are underway now for a huge number of vitamin D derivatives in order to propose novel ligands for VDR, which can act as candidate for potent drugs against immunological diseases, such as cancer.