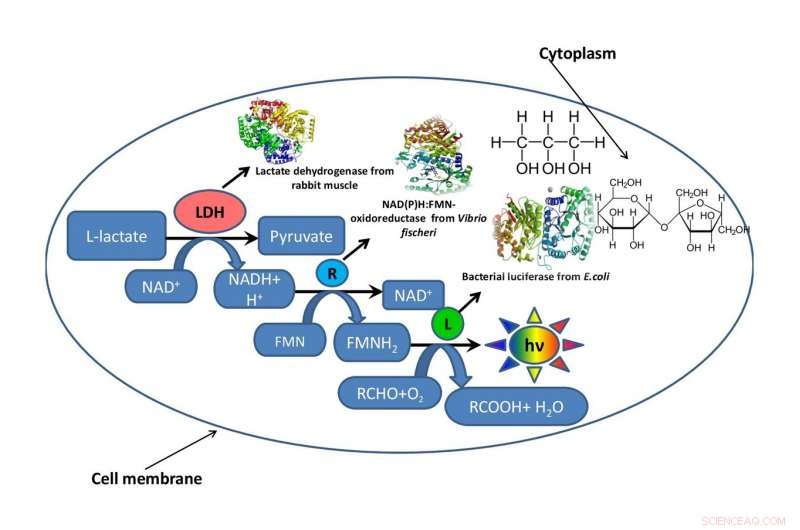
Schéma d'une cellule bactérienne avec un fragment d'une chaîne métabolique fonctionnant à l'intérieur entouré de glycérol ou de saccharose qui imitent l'environnement intracellulaire. Crédit :Oleg Sutormin.
Une équipe de l'Institut de biologie fondamentale et de biotechnologie de SFU a utilisé du glycérol et du saccharose pour simuler l'environnement intracellulaire de bactéries luminescentes et a réalisé un certain nombre de réactions enzymatiques. Ils espèrent développer des fragments de chaînes métaboliques de différentes longueurs et étudier les réactions fermentaires dans des conditions proches de l'intracellulaire. La recherche a été publiée dans le Catalyse moléculaire journal.
Des centaines de réactions impliquant des enzymes se produisent constamment dans les cellules. Pour les étudier plus en détail, les scientifiques tentent de créer des modèles expérimentaux complets de l'environnement intracellulaire. Une caractéristique intéressante de ces modèles d'environnement artificiel est la possibilité d'ajuster leurs paramètres pour comprendre comment une certaine réaction enzymatique réagirait et les différences entre les réactions enzymatiques dans une cellule et celles dans des conditions de tube.
Afin de comprendre comment la viscosité du mélange réactionnel affecte la vitesse des processus enzymatiques, une équipe de l'Institut de biologie fondamentale et de biotechnologie de SFU a simulé l'environnement intracellulaire à l'aide de deux solvants organiques, le glycérol et le saccharose. Pour tester l'effet de la viscosité du mélange réactionnel, les scientifiques ont utilisé un fragment d'une chaîne métabolique bioluminescente.
Le travail comportait trois étapes. Au premier étage, les biophysiciens ont développé plusieurs systèmes modèles artificiels à base de glycérol et de saccharose avec différentes concentrations de composants, mais les mêmes niveaux de viscosité du milieu réactionnel. Au deuxième étage, ils ont déterminé comment la viscosité du mélange réactionnel affectait la vitesse d'une réaction enzymatique dans le système couplé de trois enzymes :LDH, NAD(P)H:FMN-oxydoréductase, et luciférase. Au troisième étage, les chercheurs ont évalué la stabilité thermique du système triple-enzyme à la plage de températures de 15 à 80 degrés.
À la suite de l'étude, les scientifiques ont conclu que le saccharose limitait la mobilité des enzymes plus efficacement que le glycérol. La limitation de la mobilité peut entraîner des changements dans la vitesse de réaction ou même dans le mécanisme. Les chercheurs recommandent une étude plus approfondie de la stabilité thermique croissante des enzymes dans des environnements de mélange réactionnel visqueux et une température croissante. Ils proposent également une approche pour construire les chaînes métaboliques multi-enzymes cellulaires à l'intérieur de la cellule bactérienne lumineuse.
"En raison du grand nombre de réactions enzymatiques à l'intérieur d'une vraie cellule, pour que le processus du métabolisme se déroule rapidement et continuellement en son sein, les enzymes doivent avoir une coopérativité élevée. Par conséquent, la plus changeante de la stabilité thermique des enzymes en présence de viscogènes, meilleure est la coopération des systèmes enzymatiques étudiés dans les conditions de la cellule réelle, et plus grande est la possibilité qu'un fragment artificiel d'une chaîne métabolique soit naturel pour une cellule bactérienne. Il est extrêmement important d'étudier l'influence des solvants organiques visqueux sur la vitesse et la stabilité thermique des réactions enzymatiques. Le caractère unique de notre étude est que nous utilisons des composés naturels - le glycérol et le saccharose qui se trouvent réellement dans la vraie cellule, contrairement aux agents de surpeuplement qui sont utilisés dans des études similaires par d'autres chercheurs, " dit Oleg Sutormin, un co-auteur de l'étude, et associé de recherche junior du Laboratoire de biotechnologies bioluminescentes de SFU.