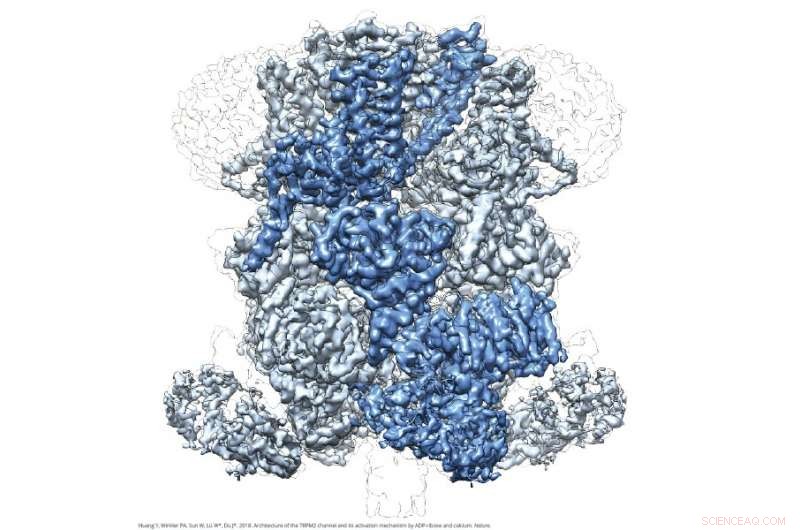
Image cryo-EM de TRPM2. Crédit :Wei Lü et Juan Du
Une équipe dirigée par des scientifiques du Van Andel Research Institute (VARI) a révélé pour la première fois la structure au niveau atomique de TRPM2, une protéine qui pourrait être une cible thérapeutique prometteuse pour des maladies telles que la maladie d'Alzheimer et le trouble bipolaire.
TRPM2 se trouve dans tout le corps et est intégralement impliqué dans la régulation de la température corporelle centrale, la médiation des réponses immunitaires et la régulation de l'apoptose, la mort programmée des cellules. Il est activé par une gamme de stimuli, y compris le stress oxydatif, qui résulte de déséquilibres chimiques et est liée à de nombreuses affections neurologiques.
"TRPM2 est absolument essentiel pour une fonction saine mais, jusqu'à aujourd'hui, il nous manquait des informations clés sur sa structure et son mécanisme d'action, " dit Juan Du, Doctorat., professeur assistant à VARI et co-auteur principal d'une étude décrivant la structure de TRPM2, publié aujourd'hui dans La nature "Nous espérons que ces résultats serviront de schéma pour concevoir des médicaments meilleurs et désespérément nécessaires pour une multitude de troubles neurologiques."
Les images au niveau atomique de TRPM2 représentent une structure en forme de cloche, avec une région de domaine transmembranaire sur l'épaule de la cloche et un domaine NUDT9-H étendu sur la lèvre de la cloche. Ils révèlent également un nouveau site de liaison médicamenteuse pour ADPR, une molécule messagère associée au stress oxydatif et au métabolisme, ce qui renverse l'opinion dominante selon laquelle TRPM2 lie ADPR au domaine NUDT9-H. Ces révélations fournissent des détails précieux qui pourraient éclairer la conception de médicaments thérapeutiques pour traiter les maladies liées à la température et prévenir la mort neuronale dans les maladies neurodégénératives.
« Bien que nous sachions depuis un certain temps que TRPM2 est un élément vital de nombreux processus biologiques et une cible potentielle pour les médicaments, nous ne savions pas exactement à quoi cela ressemblait ou comment cela fonctionnait, " dit Wei Lu, Doctorat., professeur assistant à VARI et co-auteur principal. "Les découvertes d'aujourd'hui changent cela, et aller un long chemin vers une compréhension plus complète de ces molécules incroyablement importantes. »
TRPM2 appartient à la superfamille TRP, un groupe de protéines qui médient les réponses aux stimuli sensoriels, comme la douleur, pression, vision, température et goût. Largement connus sous le nom de canaux ioniques, des protéines comme TRP se nichent dans les membranes des cellules, agissant comme gardiens des signaux chimiques entrant et sortant de la cellule. Les huit protéines qui composent la sous-famille TRPM font partie de ce groupe plus large.
À ce jour, TRPM2 est la quatrième protéine TRPM dont la structure est résolue au niveau atomique et la deuxième protéine TRPM à être déterminée à la résolution atomique à VARI. En décembre, Lü et Du ont révélé la structure de TRPM4, qui joue un rôle dans la régulation de l'apport sanguin au cerveau. C'était la première structure d'une protéine TRPM déterminée à une résolution atomique.
Les résultats ont été rendus possibles grâce à la suite de pointe de microscopie cryoélectronique de pointe David Van Andel de VARI, qui permet aux scientifiques de voir certains des plus petits composants de la vie dans des détails exquis. Le plus grand microscope de VARI, le Titan Krios, est si puissant qu'il peut visualiser des molécules 1/10, 000e de la largeur d'un cheveu humain.