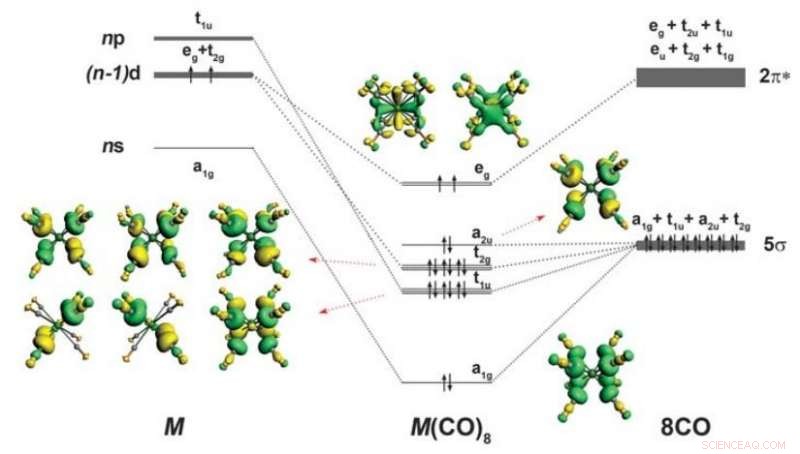
Schéma de liaison et forme des orbitales de valence occupées de M(CO)
Une équipe de chercheurs de l'Université de Fudan et de l'Université technique de Nanjing, à la fois en Chine, a démontré que le principe des 18 électrons n'est pas limité aux métaux de transition. Dans leur article publié dans la revue Science , le groupe décrit leur travail avec le calcium, atomes de strontium et de baryum et ce qu'ils ont trouvé. P. B. Armentrout de l'Université de l'Utah propose un article Perspective sur le travail effectué par l'équipe en Chine dans le même numéro de revue.
Comme de nombreux étudiants en chimie s'en souviendront, les éléments du tableau périodique sont classés en éléments de groupe principaux divisés par blocs - ils comprennent les blocs s et p, le bloc d, qui comprend les métaux de transition, et bien sûr, le bloc f, qui comprend les actinides et les lanthanides. Aussi, les principaux éléments du groupe calcium, le strontium et le baryum sont connus pour former des liaisons en utilisant leurs orbitales, et suivez ce que l'on appelle la règle de l'octet, où les atomes se retrouvent avec huit électrons dans leur couche de valence. Métaux de transition, d'autre part, ont cinq autres orbitales d qui, une fois remplies, donnent une formation stable avec 18 électrons. Dans ce nouvel effort, les chercheurs ont montré que même les principaux éléments du groupe comme le calcium, le strontium et le baryum peuvent être amenés à suivre la règle de l'octet, démontrant que la règle de l'octet ne se limite pas aux seuls métaux de transition. Le groupe suggère que cette découverte indique que l'ancienne règle de l'octet, qui se trouve dans pratiquement tous les manuels de chimie, n'est pas vraiment correct dans certains cas.
Dans leur travail, les chercheurs ont montré que les principaux éléments du groupe pouvaient former des complexes de 18 électrons avec le monoxyde de carbone lorsqu'ils étaient placés dans une chambre très froide. Ils rapportent qu'ils étudiaient le Ba(CO) + et Ba(CO) - en utilisant l'analyse spectrale lorsqu'ils ont trouvé quelque chose qui n'allait pas - les nombres d'ondes pour le mode d'étirement C-O étaient étrangement décalés. Une analyse de leurs découvertes a suggéré que les atomes de Ba avaient des orbitales d plutôt que les orbitales s ou p attendues. Pour démontrer leurs découvertes théoriques, ils ont placé des mélanges de Ba, Sr et Ca dans une matrice de néon froid et ont utilisé la spectroscopie infrarouge pour mieux voir ce qui se passait.
© 2018 Phys.org