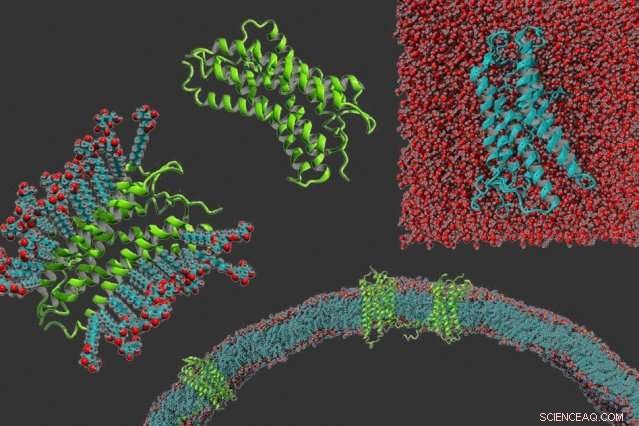
Dans le sens des aiguilles d'une montre à partir de la gauche :un récepteur couplé aux protéines g dans un détergent, la protéine seule, un récepteur couplé aux protéines g qui a été rendu soluble dans l'eau, et des récepteurs couplés aux protéines g intégrés dans une membrane. Crédit :Michael Skuhersky
Environ 30 pour cent des protéines codées par le génome humain sont des protéines membranaires, des protéines qui traversent la membrane cellulaire afin de faciliter la communication entre les cellules et leur environnement. Ces molécules sont essentielles à l'apprentissage, voyant, et sentir les odeurs, parmi de nombreuses autres fonctions.
Malgré la prévalence de ces protéines, les scientifiques ont eu des difficultés à étudier leurs structures et leurs fonctions car les parties liées à la membrane sont très hydrophobes, ils ne peuvent donc pas être dissous dans l'eau. Cela rend beaucoup plus difficile la réalisation d'analyses structurelles, comme la cristallographie aux rayons X.
Dans une avancée qui pourrait faciliter la réalisation de ce type d'étude de structure, Les chercheurs du MIT ont développé un moyen de rendre ces protéines solubles dans l'eau en échangeant certains de leurs acides aminés hydrophobes contre des acides aminés hydrophiles. La technique repose sur un code beaucoup plus simple que les méthodes précédemment développées pour rendre ces protéines solubles, qui reposent sur des algorithmes informatiques qui doivent être adaptés à chaque protéine au cas par cas.
"S'il n'y a pas de règle à suivre, il est difficile pour les gens de comprendre comment faire, " dit Shuguang Zhang, chercheur principal au Center for Bits and Atoms du MIT Media Lab. « L'outil doit être simple, quelque chose que tout le monde peut utiliser, pas une simulation informatique sophistiquée que seules quelques personnes savent utiliser."
Zhang est l'auteur principal de l'étude, qui apparaît dans le Actes de l'Académie nationale des sciences la semaine du 27 août. D'autres auteurs du MIT sont l'ancien professeur invité Fei Tao, post-doctorant Rui Qing, ancien professeur invité Hongzhi Tang, étudiant diplômé Michael Skuhersky, ancienne de premier cycle Karolina Corin '03, SM '05, doctorat '11, ancienne post-doctorante Lotta Tegler, étudiant diplômé Asmamaw Wassie, et l'ancien premier cycle Brook Wassie '14.
Un code simple
Sur les 8 environ, 000 protéines membranaires connues présentes dans les cellules humaines, les scientifiques ont découvert des structures depuis environ 50. Elles sont largement considérées comme très difficiles à travailler car une fois extraites de la membrane cellulaire, ils ne conservent leur structure que s'ils sont mis en suspension dans un détergent, qui imite l'environnement hydrophobe de la membrane cellulaire. Ces détergents sont chers, et il n'y a pas de détergent universel qui fonctionne pour toutes les protéines membranaires.
Zhang a commencé à travailler sur une nouvelle façon de s'attaquer à ce problème en 2010, inspiré par feu Alexander Rich, un professeur de biologie du MIT. Rich a posé la question de savoir si les structures protéiques appelées hélices alpha, qui constituent la majeure partie de la partie membranaire des protéines, pourrait passer d'hydrophobe à hydrophile. Zhang a immédiatement commencé à trouver des solutions possibles, mais le problème s'est avéré difficile. Au cours des huit dernières années, il a eu plusieurs étudiants et chercheurs invités pour travailler sur son idée, plus récemment Qing, qui a réussi.
L'idée clé qui a permis à Zhang de développer le code est le fait qu'une poignée d'acides aminés hydrophobes ont des structures très similaires à certains acides aminés hydrophiles. Ces similitudes ont permis à Zhang de proposer un code dans lequel la leucine est convertie en glutamine, l'isoleucine et la valine sont converties en thréonine, et la phénylalanine est convertie en tyrosine.
Un autre facteur important est qu'aucun de ces acides aminés n'est chargé, leur échange semble donc avoir un effet minime sur la structure globale de la protéine. En réalité, l'isoleucine et la thréonine sont si similaires que les ribosomes, les structures cellulaires qui assemblent les protéines, insérez parfois le mauvais, environ une fois toutes les 200 à 400 occurrences.

Le postdoctorant Rui Qing et le chercheur principal Shuguang Zhang ont dirigé les efforts visant à trouver un moyen simple de rendre les protéines liées à la membrane hydrosolubles. Crédit :Jun Ni
Les chercheurs appellent leur code le code QTY, après les trois lettres qui représentent la glutamine, thréonine, et la tyrosine, respectivement.
Dans leurs premiers efforts pour mettre en œuvre ce code, les chercheurs n'ont substitué qu'une petite fraction des acides aminés hydrophobes noyés dans la membrane, mais les protéines résultantes avaient encore besoin d'un peu de détergent pour se dissoudre. Ils ont augmenté le taux de remplacement à environ 50 pour cent, mais les protéines n'étaient pas encore totalement solubles dans l'eau, ils ont donc remplacé tous les cas de glutamine, isoleucine, valine, et la phénylalanine incorporée dans les membranes. Cette fois, ils ont réussi.
"Ce n'est que lorsque nous remplaçons tous les résidus hydrophobes dans les régions transmembranaires que nous pouvons obtenir des protéines stables et totalement exemptes de détergent dans un système aqueux, " dit Qing.
Similitudes structurelles
Dans cette étude, les chercheurs ont démontré leur technique sur quatre protéines appartenant à une classe de protéines appelées récepteurs couplés aux protéines G. Ces protéines aident les cellules à reconnaître les molécules, comme les hormones, ou des molécules immunitaires, appelés chimiokines, et déclencher une réponse appropriée au sein de la cellule.
Joël Sussman, professeur de biologie structurale au Weizmann Institute of Science, a décrit la nouvelle méthode comme « incroyablement simple et élégante ».
"Bien qu'un certain nombre de scientifiques aient essayé de trouver un moyen de" solubiliser "les récepteurs couplés aux protéines G et d'autres protéines membranaires intégrales, jusqu'à présent, leurs méthodes n'étaient pas d'usage général et impliquaient souvent des méthodes de calcul très complexes qui ne seraient pas largement applicables, " dit Sussman, qui n'a pas participé à la recherche.
Les chercheurs travaillent toujours à l'obtention des structures précises de ces protéines en utilisant la cristallographie aux rayons X ou la résonance magnétique nucléaire (RMN), mais ils ont effectué des expériences qui suggèrent que les structures sont similaires. Dans une, ils ont montré que les protéines hydrosolubles se dénaturent à presque la même température que les versions originales des protéines. Ils ont également montré que les protéines modifiées se lient aux mêmes molécules cibles auxquelles les protéines d'origine se lient, bien que pas aussi fortement.
Pouvoir synthétiser des versions hydrosolubles de ces protéines pourrait permettre de nouvelles applications, tels que des capteurs capables de détecter les polluants environnementaux, disent les chercheurs.
Une autre possibilité consiste à concevoir des versions hydrosolubles des protéines qui se lient aux molécules normalement exprimées par les cellules cancéreuses, qui pourraient être utilisés pour diagnostiquer des tumeurs ou identifier des cellules cancéreuses métastatiques dans des échantillons de sang, dit Zhang. Les chercheurs pourraient également créer des molécules hydrosolubles dans lesquelles un récepteur membranaire auquel les virus se lient normalement est attaché à une partie d'un anticorps. Si ces "leurres thérapies" étaient injectées dans le corps, les virus se lieraient aux récepteurs puis seraient éliminés par le système immunitaire, qui serait activé par la partie anticorps.