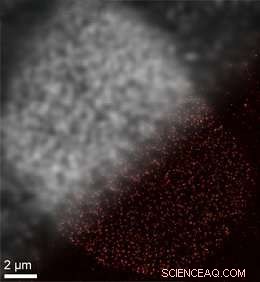
La microscopie à super-résolution DNA-PAINT basée sur SOMAmer permet une résolution spatiale améliorée. En haut à gauche :Image traditionnelle limitée par diffraction de protéines complexes à pores nuls sur une membrane de cellule nucléaire. En bas à droite :image super-résolution DNA-PAINT obtenue avec les liants SOMAmer. Crédit :Jungmann/LMU
Ralf Jungmann s'intéresse aux processus qui se déroulent dans des dimensions spatiales incroyablement petites. Jungmann est professeur de physique expérimentale à la Ludwig-Maximilians-Universitaet (LMU) à Munich, et dirige un groupe de recherche en imagerie moléculaire et bionanotechnologie au Max Planck Institute for Biochemistry (Martinsried), et se concentre sur l'extension des capacités de la microscopie optique. Son objectif est de visualiser les interactions moléculaires qui ont lieu au sein de cellules individuelles. Afin de surveiller les réseaux protéiques impliqués dans de tels processus, il utilise de courts brins d'ADN attachés de manière covalente à divers marqueurs de fluorescence comme sondes pour localiser des protéines cibles portant des étiquettes d'ADN complémentaires. En exploitant la spécificité de séquence et la polyvalence de l'hybridation d'ADN, il est possible d'imager les distributions d'un grand nombre de molécules dans des cellules individuelles à une super-résolution. La combinaison de séquences d'ADN avec différents composés fluorescents explique pourquoi la technique porte le nom DNA-PAINT.
L'une des principales restrictions concernant le potentiel de la microscopie à fluorescence à super-résolution concerne les marqueurs utilisés pour détecter les cibles d'intérêt biologique :ils sont tout simplement trop gros. "Nous travaillons avec une résolution instrumentale de moins de 10 nanomètres. Mais les marqueurs fluorescents classiquement utilisés pour marquer les protéines sont beaucoup plus gros que cela. Et ce facteur a entravé les progrès de tout ce domaine de recherche, " explique Jungmann. C'est ce qui a motivé le travail décrit dans une nouvelle étude, qui paraît dans le journal Méthodes naturelles . Dans ce document, Jungmann et ses collègues explorent l'utilisation de ce qu'on appelle les SOMAmers, une classe spéciale d'aptamères d'ADN, comme moyen de réduire la taille des marqueurs utilisés dans DNA-PAINT. Le terme «aptamère» a été inventé à l'origine pour désigner des molécules d'ARN simple brin qui se replient en des formes tridimensionnelles définies et sont capables de détecter spécifiquement des espèces de protéines uniques. Les aptamères de Jungmann sont des molécules d'ADN simple brin, qui se replient en formes tridimensionnelles définies qui peuvent se lier directement à des protéines spécifiquement ciblées.
« Le marqueur idéal utilisé pour marquer efficacement et spécifiquement les protéines doit répondre à plusieurs critères, " dit Sébastien Strauss, membre du groupe de Jungmann et premier auteur de la nouvelle étude. "Il doit être le plus petit possible, et il doit se lier aux cibles de manière stoechiométrique pour permettre une quantification précise. En outre, il serait idéal de synthétiser des bibliothèques entières de ces composés et d'identifier rapidement des marqueurs appropriés pour les protéines d'intérêt. Afin d'évaluer le potentiel des aptamères d'ADN, l'équipe LMU a collaboré avec la firme américaine SomaLogic, qui avait déjà conçu, à d'autres fins, une vaste gamme d'aptamères modifiés (SOMAmères) qui peuvent spécifiquement lier des milliers de protéines différentes. Dans la nouvelle étude, les chercheurs munichois ont modifié une sélection de ces aptamères pour DNA-PAINT et développé des protocoles de marquage efficaces pour les cellules fixes et vivantes. L'étude actuelle montre qu'il est en effet possible d'améliorer la résolution atteignable avec les marqueurs de fluorescence conventionnels en utilisant ces nouveaux réactifs de marquage en combinaison avec la microscopie à super-résolution DNA-PAINT.
"Nous nous attendons à ce que la nouvelle méthode donne un coup de pouce significatif à la microscopie à super-résolution, notamment en ce qui concerne son domaine d'application en biologie, ", explique Ralf Jungmann. Son objectif est d'utiliser DNA-PAINT pour visualiser et surveiller simultanément autant de protéines et leurs interactions que possible. Dans de futures expériences, lui et ses collègues prévoient d'utiliser la nouvelle méthode de marquage pour imager des réseaux de protéines entiers à haute résolution. "Nous serons en mesure d'aborder des questions biologiques et biomédicales qui étaient jusqu'à présent inaccessibles expérimentalement."