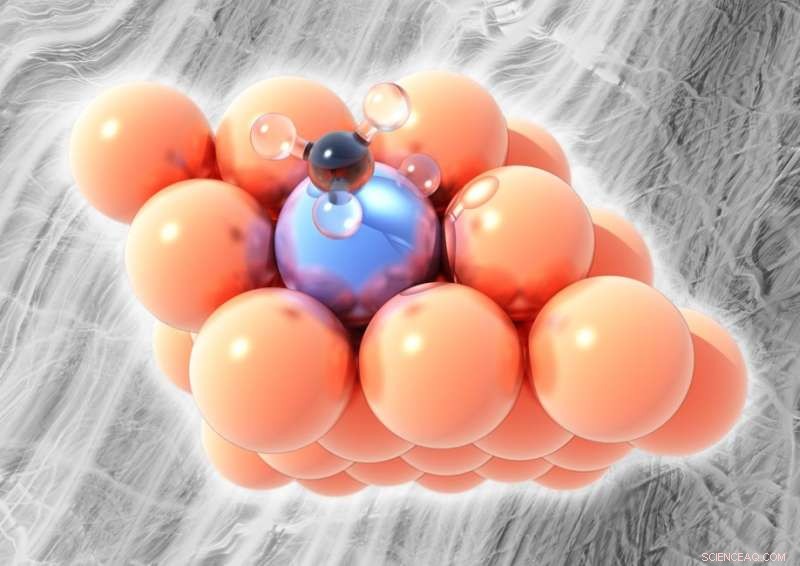
Sur la photo, l'alliage monoatome platine-cuivre. Le cuivre (orange) est incapable de rompre les liaisons entre le carbone (noir) et l'hydrogène (clair) dans les dérivés du méthane, sauf à des températures plus élevées, mais un seul atome de platine (bleu glacial) dans la couche superficielle de l'alliage peut casser des atomes d'hydrogène à des températures relativement basses sans former de coke. Crédit :Michail Stamatakis, UCL
Les progrès technologiques dans la stimulation des puits de pétrole et de gaz au cours de la dernière décennie permettent maintenant la production de gaz naturel à partir de gaz de schiste piégé dans des formations rocheuses souterraines. Avec l'augmentation soudaine de la disponibilité du gaz de schiste, les scientifiques ont regagné de l'intérêt pour l'activation carbone-hydrogène (C-H), le processus de rupture des liaisons C-H de gaz tels que le méthane pour former des chaînes d'hydrocarbures pouvant être utilisées comme carburant.
Mais les scientifiques sont loin de glaner ces carburants à partir du gaz de schiste - la plupart des catalyseurs pour l'activation C-H brisent trop d'atomes d'hydrogène, laissant derrière lui un solide de carbone indésirable appelé coke.
Désirant un alliage métallique qui fonctionnerait comme un catalyseur pour l'activation C-H tout en restant résistant au coke, une équipe dirigée par Charles Sykes de l'Université Tufts a conçu un alliage composé de platine, un métal réactif, et de cuivre, un métal inerte. Dans une série d'expériences en laboratoire, L'équipe de Sykes a examiné le cuivre pur, platine pur, et un alliage monoatome platine-cuivre (SAA) pour déterminer les interactions de chaque matériau avec les hydrocarbures dérivés du méthane, molécules qui se trouvent naturellement dans le gaz de schiste. L'équipe a découvert que le SAA platine-cuivre était résistant à la cokéfaction.
Suite à cette découverte, le groupe Multiscale Computational Catalysis &Materials Science dirigé par Michail Stamatakis de l'University College London a utilisé les ressources de calcul haute performance (HPC) de l'Oak Ridge Leadership Computing Facility (OLCF) pour démasquer les détails des expériences via des simulations. Matthieu Darby, un postdoctorant à l'époque et maintenant récipiendaire du prix doctoral du Engineering and Physical Science Research Council du Royaume-Uni travaillant dans le groupe Stamatakis, effectué les calculs du projet.
Darby a découvert qu'à basse température, le platine extrait rapidement les hydrogènes du méthane, conduisant à la formation de dépôts de carbone; le cuivre est incapable de rompre les liaisons C-H, sauf à haute température. L'alliage platine-cuivre de l'équipe, cependant, s'est avéré efficace pour rompre les liaisons C-H à des températures intermédiaires sans former de coke. Comme du cuivre pur, l'alliage était également capable de former des chaînes de deux et trois molécules de méthane, et pouvait y parvenir à une température de plus de 100 degrés Celsius plus froide que celle requise pour le cuivre.
"Ces calculs sont très coûteux en temps de calcul. Pour certains, si vous les exécutez sur votre ordinateur portable, l'exécution d'un calcul peut prendre plusieurs mois, " dit Darby. " A l'OLCF, cela peut prendre peut-être un jour ou deux car vous avez des centaines de cœurs avec lesquels travailler."
Des supercalculateurs puissants à l'OLCF, une installation d'utilisateurs du bureau des sciences du département américain de l'énergie (DOE) située au laboratoire national d'Oak Ridge du DOE, résoudre des problèmes scientifiques complexes en énergie, matériaux, chimie, et bien d'autres domaines scientifiques. Les résultats des simulations de l'équipe expliquent les réactions du platine et du cuivre avec le méthane et proposent un nouveau catalyseur résistant au coke.
Armé de ces nouvelles connaissances, les expérimentateurs de Tufts ont créé une réplique à micro-niveau des performances d'une véritable usine chimique pour mieux comprendre le processus. Le projet démontre que la théorie peut être utilisée pour affiner les expériences en fournissant une compréhension fondamentale, préparer le terrain pour des travaux expérimentaux à plus grande échelle.
Un problème de cokéfaction
Les carburants courants qui existent sous forme de chaînes de molécules d'hydrocarbures comprennent le propane, souvent utilisé dans les fours pour la chaleur, et butane, le liquide que l'on trouve dans la plupart des briquets. En utilisant l'activation C–H, les scientifiques peuvent déclencher des réactions au sein de l'hydrocarbure le plus simple, le méthane, et ainsi encourager ces molécules à se lier pour former des carburants utiles. Parce que les formations de schiste sont abondantes et les sources d'hydrocarbures plus longues (par exemple, pétrole brut) s'épuisent, les scientifiques cherchent des moyens de convertir catalytiquement le méthane en ces carburants.
Les métaux de transition tels que le platine et le nickel sont des catalyseurs efficaces, mais ils provoquent également la formation de grandes quantités de dépôts de coke obstructifs. Cette couche de carbone recouvre le dessus du métal, rendant les molécules de méthane restantes incapables de réagir avec le reste du matériau métallique.
"Le coke est un gros problème en chimie industrielle, " dit Darby. " Une fois qu'il est déposé, vous devez sortir votre métal du réacteur, le nettoyer, et le remettre en place. Cela implique soit de fermer l'usine chimique géante, soit de chauffer le métal à des températures dangereusement élevées. "
Contrairement à leur capacité à séparer rapidement les hydrogènes du méthane, le platine et le nickel sont limités dans la fabrication d'hydrocarbures à longue chaîne en raison de la cokéfaction. Récemment, les scientifiques ont recherché des alliages constitués d'un métal actif tel que le platine ou le nickel et d'un métal inerte tel que le cuivre ou l'argent. Mais même avec ce genre d'alliages, la cokéfaction continue de poser problème.
L'équipe de Sykes a développé un nouveau SAA, ou alliage à un seul atome, avec seulement 1 atome de platine pour 100 atomes de cuivre, pour lutter contre la cokéfaction. Les atomes de platine ont été isolés dans la couche superficielle du métal pour s'assurer qu'ils ne réagiraient pas trop. Les expériences ont montré que des atomes de platine isolés dans le cuivre réagissent toujours pour rompre les liaisons C-H, mais pas au point de former du coke.
Darby a ensuite simulé du platine pur, cuivre pur, et la SAA pour déterminer à laquelle des trois surfaces un atome de carbone se lie le plus fortement. Il a répété ce processus avec du carbone lié à un, deux, Trois, et quatre hydrogènes ainsi que des atomes d'hydrogène seuls. Il a découvert que ces molécules se lient au cuivre avec une affinité plus élevée qu'au platine, et beaucoup plus d'énergie est nécessaire pour que le cuivre rompe les liaisons C-H. Les résultats sont essentiels pour expliquer pourquoi le cuivre est un catalyseur inefficace.
"Le platine peut rompre les liaisons C-H des millions de fois plus vite que le cuivre, et l'alliage est quelque part entre les deux, " dit Darby. " Avant ce SAA, les gens ne pouvaient pas lier deux ou trois molécules de méthane à basse température sans désactiver le métal. Nous avons montré que nous pouvons en obtenir jusqu'à trois."
Cette découverte est importante car il n'y a jamais eu auparavant d'alliage capable de rompre efficacement les liaisons C-H et de rester résistant au coke.
"Notre SAA démontre qu'une solution à ce problème pourrait être possible, " a déclaré Darby. " J'espère que cela aidera la communauté de la chimie à essayer plus de combinaisons SAA et à voir si nous pouvons réellement trouver l'alliage qui sera parfait pour cela. "
Particules de la taille d'un atome
Les simulations ont été réalisées sur des ressources OLCF en utilisant le Vienna ab initio Simulation Package (VASP), un code conçu pour modéliser les matériaux à l'échelle atomique. VASP est le plus populaire du genre et est parfaitement adapté pour une utilisation sur des ordinateurs parallèles hautes performances tels que ceux de l'OLCF.
"Nous modélisons les choses au niveau de l'atome, " a déclaré Darby. "Nous avons modélisé 100 particules de la taille d'un atome:le catalyseur et les molécules de méthane. Nous avons ensuite calculé la quantité d'énergie nécessaire pour convertir le méthane en autre chose."
En comparant ces calculs entre eux, Darby a pu expliquer les résultats expérimentaux. En reproduisant tout dans l'expérience, l'équipe a pu voir jusqu'au niveau de l'atome et simuler le nombre de ruptures de liaisons spécifiques, ce qui est impossible à compter dans une expérience.
L'équipe espère qu'un jour un alliage pourra lier jusqu'à huit méthanes (l'octane composé), qui peut ensuite être utilisé pour alimenter les voitures. Les résultats du projet et les travaux en cours du groupe Stamatakis permettront aux expérimentateurs de se concentrer sur les systèmes d'alliages les plus importants plutôt que de tester des systèmes aléatoires.
"Avec l'expérience, il s'agit principalement d'essais et d'erreurs, " dit Darby. " Les simulations nous donnent une feuille de route. "