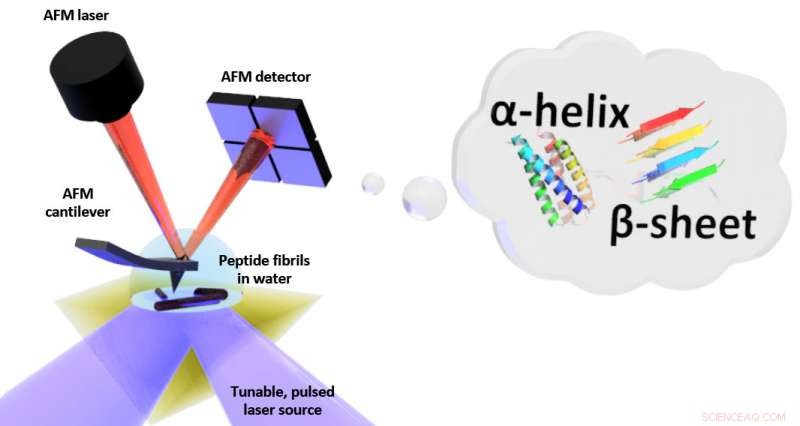
Schéma du montage pour la Résonance Photo-Thermique Induite (PTIR), qui comprend une source laser infrarouge et un microscope à force atomique (AFM) en porte-à-faux avec une pointe acérée qui touche l'échantillon et vibre en réponse à l'expansion induite par la lumière de l'échantillon. Le PTIR peut déterminer le motif de pliage (appelé par exemple hélice , feuillet β) de peptides (chaînes d'acides aminés) dans l'eau avec une résolution à l'échelle nanométrique. Crédit :NIST
Bricoler une méthode qu'ils ont contribué à développer au cours des dernières années, des scientifiques ont pour la première fois mesuré à l'échelle nanométrique les motifs caractéristiques des plis qui donnent aux protéines leur forme tridimensionnelle dans l'eau. Développé par des chercheurs du National Institute of Standards and Technology (NIST) et leurs collègues, cette technique aidera les scientifiques à mieux comprendre le comportement des biomolécules dans des environnements aqueux similaires à ceux des cellules. Ces idées, à son tour, pourrait accroître notre compréhension des principales maladies, dont la maladie d'Alzheimer, qui sont liés à des "erreurs" dans le repliement des protéines.
La vie telle que nous la connaissons ne pourrait pas survivre si les protéines ne se repliaient pas selon des schémas précis menant à des hélices, feuilles et autres formes qui donnent aux protéines leur structure tridimensionnelle. Les formes précises des protéines leur permettent de transporter l'oxygène, repousser les bactéries nocives et effectuer d'autres tâches essentielles dans le corps. Les protéines qui se replient mal ne peuvent pas fonctionner et génèrent parfois des fragments toxiques, tels que ceux associés aux troubles neurodégénératifs.
Pour comprendre les subtilités du pliage, les scientifiques doivent étudier l'arrangement détaillé des chaînes d'acides aminés qui sont plus courtes et plus simples que les protéines, appelées peptides, et comment elles se replient, assembler et faire pivoter pour créer une variété de formes, ou conformations. Les biologistes préfèrent examiner les protéines et les peptides immergés dans l'eau car cet environnement se rapproche étroitement des conditions à l'intérieur des cellules vivantes.
Techniques précédemment établies pour déterminer la conformation des protéines, comme la spectroscopie infrarouge, n'ont pas la résolution spatiale fine pour étudier les assemblages minuscules et divers de protéines correctement repliées et mal repliées. En outre, ces techniques ne fonctionnent pas bien dans un environnement aqueux car l'eau absorbe fortement la lumière infrarouge, confondre l'analyse. L'eau avait également posé de sérieux défis à une technique pionnière, connue sous le nom de résonance photo-thermique induite (PTIR), qui a récemment permis aux chercheurs d'examiner la structure et la conformation des peptides dans l'air avec une résolution à l'échelle nanométrique.
Les chercheurs du NIST et leurs collègues ont maintenant démontré que le PTIR peut être adapté pour obtenir une structure conformationnelle à l'échelle nanométrique dans l'eau en utilisant deux peptides chimiquement similaires connus sous le nom de diphénylalanine et Boc-diphénylalanine. La diphénylalanine est liée à la bêta-amyloïde, un collant, peptide plus gros lié à la maladie d'Alzheimer.
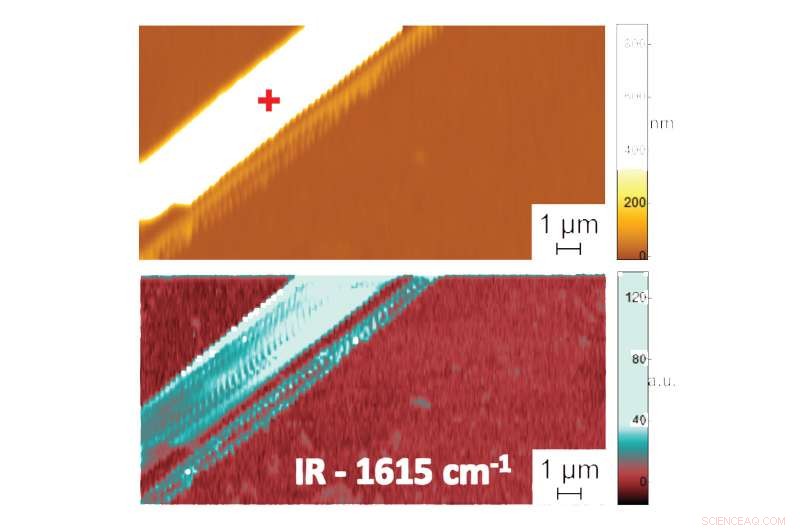
Apparaît dans :La forme dans l'eau :premières mesures à l'échelle nanométrique de la structure repliée des biomolécules dans les liquides. Image au microscope à force atomique montrant la topographie (en haut) et l'image d'absorption PTIR indiquant la composition et la conformation (en bas) d'une fibrille peptidique de diphénylalanine dans l'eau. Donnée supplémentaire, enregistrer le spectre du rayonnement infrarouge absorbé par les fibrilles peptidiques, fournit des informations sur leur modèle de pliage. Le spectre PTIR indiqué, par exemple, que la diphénylalanine prend une conformation de feuille β antiparallèle pure. Crédit :NIST
"Le PTIR est une technique puissante qui s'était déjà révélée prometteuse pour l'étude des systèmes biologiques, mais la possibilité de l'utiliser avec des échantillons en milieu liquide améliorera grandement son utilisation dans ce domaine, " a déclaré Georg Ramer du NIST et de l'Université du Maryland à College Park. Ramer et Andrea Centrone, chercheur au NIST, avec leurs collègues de l'Université de Cambridge en Angleterre, ont décrit leur travail dans un article récemment mis en ligne sur ACS Nano .
Le PTIR détermine la composition chimique des matériaux avec une résolution à l'échelle nanométrique en combinant un microscope à force atomique (AFM) avec la lumière d'un laser infrarouge qui fonctionne sur une gamme de longueurs d'onde. Les longueurs d'onde caractéristiques de la lumière infrarouge qui sont absorbées par l'échantillon s'apparentent à une empreinte moléculaire, révélant sa composition chimique. A chaque site de l'échantillon où l'infrarouge est absorbé, le matériau chauffe, l'amenant à rapidement, mais très légèrement, développer. L'expansion est détectée, avec la pointe pointue de l'AFM dépassant d'un porte-à-faux, qui oscille comme un plongeoir à chaque fois que l'échantillon se dilate. Plus la lumière est absorbée par l'échantillon, plus son expansion est grande et plus sa force est grande, ou d'amplitude, des oscillations.
Aussi bon que soit le PTIR, l'utilisation de la méthode dans un environnement aquatique est problématique. L'eau absorbe fortement la lumière infrarouge, produisant un signal d'absorption qui peut interférer avec les efforts pour discerner la structure chimique de l'échantillon. En outre, la force de traînée exercée par l'eau est beaucoup plus forte que dans l'air et affaiblit généralement le signal PTIR, car il amortit fortement les oscillations du porte-à-faux de l'AFM.
Pour limiter l'absorption par l'eau de la lumière infrarouge, l'équipe a placé un prisme entre le laser et l'échantillon. Le prisme servait à confiner la lumière infrarouge à la surface de l'échantillon, minimiser la quantité qui pourrait s'échapper et interagir avec l'eau. Pour résoudre le problème d'amortissement, l'équipe a utilisé un laser qui pouvait fonctionner à des fréquences allant jusqu'à 2, 000 kilohertz. Cela a permis aux chercheurs de faire correspondre la fréquence des impulsions laser à l'une des fréquences les plus élevées auxquelles le cantilever oscille. Comme pousser un enfant sur une balançoire au bon intervalle, l'adaptation de fréquence a amélioré l'amplitude des oscillations du porte-à-faux, compensant partiellement l'amortissement dû à l'eau.
Pour démontrer l'exactitude de leur méthode, l'équipe a comparé les mesures PTIR de diphénylalanine et d'autres échantillons de peptides dans deux environnements :l'eau et l'air. (Les peptides se replient de manière similaire dans les deux milieux, ce qui facilite la comparaison.) Remarquablement, les scientifiques ont obtenu une résolution spatiale et un contraste similaires dans l'eau et l'air, démontrant pour la première fois que des mesures en milieu aquatique peuvent être effectuées avec précision, révélant la conformation précise des peptides avec une résolution à l'échelle nanométrique.
"Cette découverte est importante pour les biologistes qui souhaitent comprendre la structure et le repliement des protéines dans des environnements aussi proches que possible de ceux des cellules, " a déclaré Centrone.