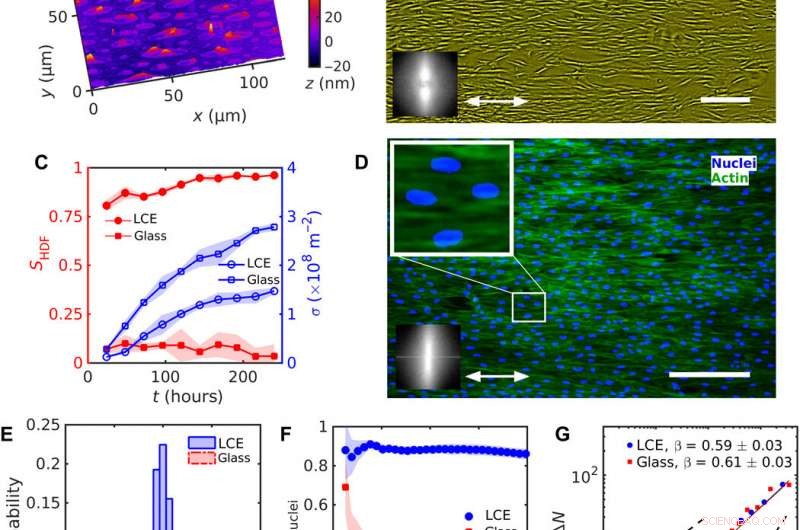
Alignement uniforme des cellules HDF sur LCE avec un nˆLCE uniforme =const. (A) Texture de microscopie holographique numérique (DHM) de la surface LCE après contact avec le milieu de croissance aqueux. (B) Texture de microscopie à contraste de phase (PCM) de cellules HDF poussant sur des substrats LCE à 120 heures après l'ensemencement. La flèche à double tête représente nˆLCE. (C) Evolution du paramètre d'ordre SHDF des corps cellulaires (symboles rouges remplis) et de la densité cellulaire (symboles bleus vides). (D) Textures microscopiques fluorescentes de cellules HDF sur LCE ; noyaux marqués par fluorescence (bleu) et protéines du cytosquelette F-actine (vert). La texture agrandie montre des noyaux allongés orientés dans la même direction que les corps des cellules. Les encarts dans (B) et (D) montrent une transformation de Fourier rapide de (B) PCM et (D) des textures fluorescentes F-actine indiquant l'ordre d'orientation le long du nˆLCE uniforme. (E) Distribution de l'orientation des noyaux. (F) Dépendance du paramètre d'ordre Snuclei des noyaux sur la taille d'une sous-fenêtre carrée. (G) Fluctuations de la densité numérique N calculées pour le nombre moyen de noyaux cellulaires N〉. Barres d'échelle, 300 µm. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz6485
Les cellules eucaryotes dans les tissus vivants peuvent affecter des processus physiologiques importants tels que l'apoptose et la migration cellulaire sur la base de la formation de motifs dynamiques avec des orientations variant dans l'espace. Cependant, il est encore difficile de projeter une carte préconçue d'ordre d'orientation sur un tissu en croissance en laboratoire. Dans une nouvelle étude maintenant publiée sur Avancées scientifiques , Taras Turiv et une équipe de recherche en physique chimique, matériaux avancés et sciences biomédicales à la Kent State University, Ohio, NOUS., a détaillé une nouvelle approche pour produire des monocouches cellulaires de fibroblastes dermiques humains. Ils ont préconçu les motifs d'orientation et les défauts topologiques à l'aide d'un élastomère à cristaux liquides photoaligné (LCE) qui a gonflé de manière anisotrope dans un milieu aqueux. L'équipe a inscrit les motifs dans le LCE, et la monocouche tissulaire a reproduit les motifs pour provoquer de fortes variations des phénotypes cellulaires (taille et forme), leur densité surfacique et leurs fluctuations de densité numérique. La nouvelle approche peut contrôler le comportement collectif des cellules dans les tissus vivants au cours de la différenciation cellulaire et de la morphogenèse des tissus pour de larges applications en bio-ingénierie et en médecine régénérative.
Les cellules qui constituent les tissus vivants présentent souvent un ordre d'orientation lorsqu'elles sont en contact étroit en raison de l'alignement mutuel des cellules anisométriques. La direction de l'orientation moyenne peut varier dans l'espace et dans le temps pour produire des défauts topologiques appelés désorientations. De tels défauts peuvent se déplacer dans le tissu pour jouer un rôle important lors des contraintes et des processus de compression-dilatation, y compris l'extraction des cellules mortes. La capacité de concevoir un échafaudage tissulaire de cellules vivantes avec un ordre et un contrôle d'orientation est importante pour les chercheurs biomédicaux afin d'étudier et de manipuler la matière vivante. Les scientifiques ont déjà produit des assemblages cellulaires ordonnés sur des surfaces fabriquées par lithographie, y compris les bords des microcanaux, dans les micro-rainures et les surfaces avec des gradients de rigidité du matériau. Dans ce travail, Turiv et al. des tissus conçus avec un degré élevé d'ordre d'orientation et une direction prédéterminée variant dans l'espace, basé sur un modèle de motifs directeurs sur des substrats LCE. L'équipe a utilisé des cellules de fibroblastes dermiques humains (HDF) comme unités de construction du tissu modélisé.
Les grains de matériau servent de rail de guidage pour les cellules HDF. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz6485
Les fibroblastes sont les cellules du tissu conjonctif les plus courantes chez les mammifères et ils conservent généralement une forme allongée plate avec des rôles importants lors de la réparation et de la restructuration des tissus, ainsi que la cicatrisation des plaies. Les scientifiques peuvent reprogrammer ces cellules en cellules souches pluripotentes pour des applications prometteuses en diagnostic et en thérapie. Dans ce travail, les effets combinés de l'ensemencement cellulaire et de la division des tissus HDF à motifs sur des substrats LCE préconçus ont produit des tissus confluents. Le LCE structuré a eu un impact marqué sur le tissu, où ils contrôlaient le modèle d'alignement et la distribution spatiale des cellules, leur densité, fluctuations, et phénotype. Le LCE à motifs a montré des emplacements de défauts topologiques dans les tissus par le biais d'interactions de surface anisotropes à des emplacements prédéterminés. Étant donné que l'alignement cellulaire et les défauts topologiques peuvent contrôler les processus biochimiques à l'échelle microscopique, ce travail ouvre la possibilité de concevoir des surfaces pour la structuration contrôlée des tissus afin de les concevoir pour des fonctions spécifiques.
Lors des expérimentations, Turiv et al. a soutenu le substrat LCE par une plaque de verre et l'a recouvert d'oxyde d'indium et d'étain (ITO) pour réduire la rugosité de surface, suivi du revêtement d'une couche de colorant azoïque photosensible et finalement recouvert le substrat d'un milieu aqueux de culture cellulaire. Les grains de surface sur le matériau ont servi de rail de guidage pour les cellules HDF. Lorsque les cellules HDF ont été mises en suspension en culture cellulaire, ils sont apparus ronds mais après fixation dans le substrat, ils ont développé une apparence allongée. Les scientifiques ont enregistré les résultats de confluence (croissance) des effets combinés de l'ensemencement cellulaire. Les résultats ont montré que l'ordre d'orientation s'est produit en raison d'interactions directes entre les cellules et le substrat LCE. Les substrats ont aidé à aligner les corps et les noyaux des cellules HDF en tant que caractéristique importante pour de nombreuses fonctions cellulaires, y compris l'expression des protéines, motilité, métabolisme et différenciation.

Alignement à motifs de cellules HDF sur LCE avec un (−1/2, +1/2) paire de défauts. (A) Texture PolScope montrant nˆLCE et un retard optique de LCE en contact avec le milieu de croissance cellulaire. (B et C) Textures DHM de surface LCE en contact avec le milieu de croissance cellulaire avec (B) -1/2 et (C) +1/2 défauts. (D) Cellules HDF colorées par fluorescence ; 4′, Noyaux cellulaires marqués au 6-diamidino-2-phénylindole (bleu) et filaments de cytosquelette d'actine marqués à la phalloïdine (vert). (E) La densité de surface des noyaux cellulaires en fonction de la distance r des noyaux de défaut +1/2 (bleu) et -1/2 (rouge). (F) Grandes fluctuations de densité en nombre ΔN des noyaux au voisinage des noyaux défectueux. (G) Images PCM de cellules HDF sur substrat LCE à 240 heures après l'ensemencement. Les points bleus et rouges indiquent l'emplacement des noyaux de défaut +1/2 et -1/2, respectivement, obtenu à partir de la texture de microscopie optique polarisée (POM) de LCE. (H) Champ d'orientation codé par couleur et (I) le schéma correspondant du directeur de tissu HDF à motifs nˆHDF imagé avec PCM. Les barres rouges dans (I) indiquent l'orientation locale des axes longs des cellules. (J) Separation between half-strength defects for horizontal and vertical director between them (see fig. S6). Barres d'échelle, 300 μm. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz6485
The HDF cells on LCE self-organized into aligned assemblies following pre-imposed directions. The team noted the behavior of cells and cell density to vary as they approached defect cores and other topological inconsistencies (bent type defects or splay type defects) on the LCE substrates. The substrates markedly impacted the HDF cells that were in contact with each other, resulting in collectively strong differences in the size and shape of cells. The marked differences indicated the influence of the predesigned patterns on the HDF cell phenotype (size and shape). Based on additional results, Turiv et al. credited the number density fluctuations in tissues to be influenced by the surface charge of director patterns and studied the issue in detail in a larger surface area.
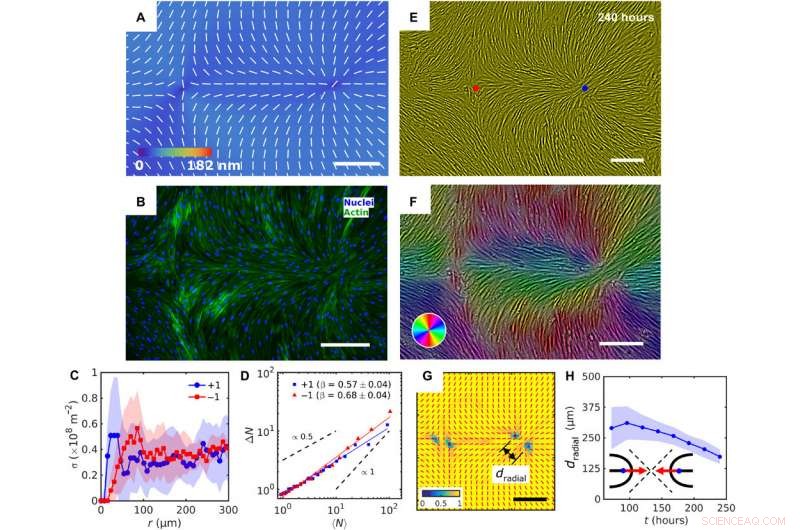
Patterned alignment of HDF cells on LCE predesigned with a pair of −1 and radial +1 (splay type) defects. (A) PolScope image of nˆLCE pattern of LCE in contact with the cell growth medium. (B) Fluorescently labeled HDF cells. (C) The surface density of cell nuclei σ as the function of distance from defect cores. (D) Large number density fluctuations ΔN with mean number of nuclei 〈N〉 showing a larger slope near −1 cores as compared to +1. (E) PCM textures of HDF cells on LCE layer at 240 hours after cell seeding. Red and blue dots denote location of −1 and +1 defects in patterned LCE obtained from crossed polarized textures. (F) Color-coded orientational field and (G) of the corresponding scheme of patterned HDF tissue director nˆHDF obtained from local anisotropy of PCM texture in (E). Red bars in (G) denote local orientation of cells’ long axes. (H) Time dependence of separation between two +1/2 defects near the +1 radial core. Barres d'échelle, 300 μm. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz6485
De cette façon, Taras Turiv and colleagues showed the dynamics and propagation of defects in patterned tissues and how they could be halted through surface anchoring forces. The scientists used LCE substrates with photopatterned structures of varying molecular orientations to grow biological tissues with predesigned cell alignment. The substrates affected cell alignment as well as cell surface density and cell phenotypes. The team noted higher density of cells in defect cores with positive topological charge, while cell density was lower near negative defects. The cells mechanistically aligned to the substrates by swelling upon contact with the aqueous cell culture medium, followed by aligning to predesigned photopatterned direction. This approach will allow materials scientists and bioengineers to design biological tissues with predetermined cell alignment and precise location of orientational defects. The outcomes can facilitate controlled cell migration, differentiation. and apoptosis. The work can be further optimized to advance the understanding of fundamental mechanisms underlying tissue development and regeneration.

The orientational order of the assemblies in +1/2 and −1/2 disclinations. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz6485
© 2020 Réseau Science X