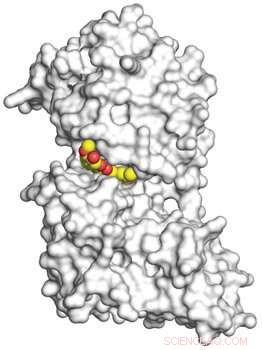
Une image 3D, obtenu par cristallographie aux rayons X, montre la curcumine en jaune et rouge se liant à l'enzyme kinase kinase 2 régulée par la tyrosine à double spécificité (DYRK2) en blanc au niveau atomique. Crédit:UC San Diego Health
Grâce à la cristallographie aux rayons X et au profil de spécificité des inhibiteurs de kinase, Chercheurs de la faculté de médecine de l'Université de Californie à San Diego, en collaboration avec des chercheurs de l'Université de Pékin et de l'Université du Zhejiang, révéler cette curcumine, un composé chimique naturel présent dans le curcuma épice, se lie à l'enzyme kinase kinase 2 régulée par la tyrosine à double spécificité (DYRK2) au niveau atomique. Cette interaction biochimique de la curcumine jusque-là non signalée conduit à l'inhibition de DYRK2 qui altère la prolifération cellulaire et réduit le fardeau du cancer.
Mais avant de se tourner vers les suppléments de curcumine ou de curcuma, Sourav Banerjee, Doctorat., Chercheur postdoctoral de la faculté de médecine de l'UC San Diego, avertit que la curcumine seule peut ne pas être la réponse.
"En général, la curcumine est expulsée du corps assez rapidement, " a déclaré Banerjee. "Pour que la curcumine soit un médicament efficace, il doit être modifié pour entrer dans la circulation sanguine et rester dans le corps assez longtemps pour cibler le cancer. En raison de divers inconvénients chimiques, la curcumine à elle seule peut ne pas être suffisante pour inverser complètement le cancer chez les patients humains."
Écrivant dans le numéro du 9 juillet du Actes de l'Académie nationale des sciences , Banerjee et ses collègues rapportent que la curcumine se lie à DYRK2 et l'inhibe, ce qui entrave le protéasome, la machinerie protéique cellulaire qui détruit les protéines inutiles ou endommagées dans les cellules, ce qui réduit le cancer chez la souris.
"Bien que la curcumine soit étudiée depuis plus de 250 ans et que ses propriétés anticancéreuses aient déjà été rapportées, aucun autre groupe n'a rapporté une structure co-cristalline de curcumine liée à une cible de protéine kinase jusqu'à présent, " dit Banerjee, premier auteur de l'étude. « En raison de leurs travaux sur la cristallographie, nos collaborateurs de l'Université de Pékin, Chenggong Ji et Junyu Xiao, nous a aidés à visualiser l'interaction entre la curcumine et DYRK2."
"Les enzymes kinases IKK et GSK3 étaient considérées comme les principales cibles de la curcumine qui conduisent à un effet anticancéreux, mais la structure co-cristalline de la curcumine avec DYRK2 ainsi qu'un profil d'inhibiteur de kinase à 140 panneaux révèlent que la curcumine se lie fortement à l'actif site de DYRK2, l'inhibant à un niveau 500 fois plus puissant que IKK ou GSK3."
Aux côtés de Jack E. Dixon, Doctorat., Professeur émérite de pharmacologie, Médecine cellulaire et moléculaire, Chimie et biochimie à l'UC San Diego, Banerjee et son équipe ont recherché des régulateurs des protéasomes pour inhiber la formation de tumeurs par les cancers dépendants du protéasome comme le cancer du sein triple négatif (TNBC) et la malignité des plasmocytes appelée myélome multiple.
À l'aide de produits biochimiques, modèles de cancer de souris et modèles cellulaires, l'équipe a découvert que la curcumine est un inhibiteur sélectif de DYRK2 et que cette nouvelle cible moléculaire a un potentiel anticancéreux prometteur non seulement pour les cancers chimiosensibles mais aussi résistants/adaptés aux inhibiteurs du protéasome.
"Nos résultats révèlent un rôle inattendu de la curcumine dans l'inhibition du DYRK2-protéasome et fournissent une preuve de concept que la manipulation pharmacologique des régulateurs du protéasome peut offrir de nouvelles opportunités pour le traitement du cancer du sein triple négatif et du myélome multiple difficiles à traiter, " dit Dixon, qui était co-auteur principal avec Xing Guo de l'Université du Zhejiang, Doctorat., sur le papier. "Notre objectif principal est de développer un composé chimique qui peut cibler DYRK2 chez les patients atteints de ces cancers."
L'épuisement de DYRK2 altère l'activité du protéasome et présente des taux de prolifération du cancer plus lents et une charge tumorale significativement réduite dans les modèles murins. En combinaison avec le médicament contre le myélome multiple approuvé par la FDA, carfilzomib, la curcumine induisait une mort beaucoup plus élevée des cellules cancéreuses tandis que les cellules normales non cancéreuses étaient moins affectées. Cela suggère que le ciblage des régulateurs du protéasome (tels que DYRK2) en combinaison avec des inhibiteurs du protéasome peut être une approche prometteuse de la thérapie anticancéreuse avec moins d'effets secondaires, mais des travaux supplémentaires sont nécessaires, dit Banerjee.