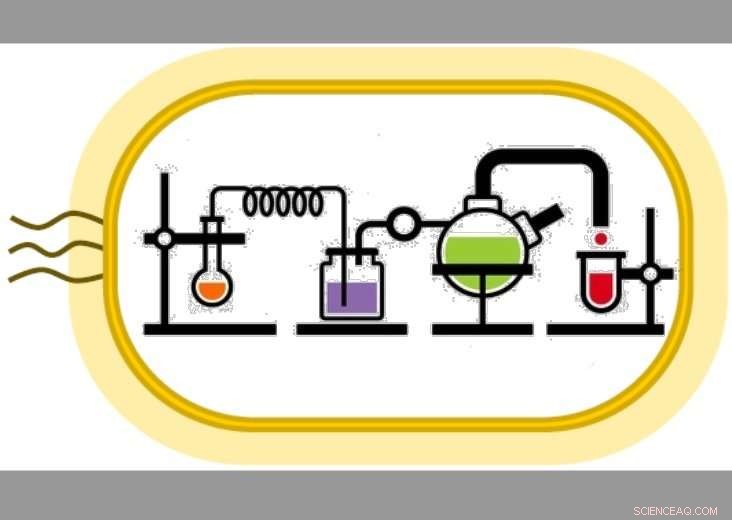
Des experts de l'Université de Nottingham ont créé un circuit auto-entretenu de réactions qui est une méthode de production chimique plus écologique et plus efficace. publié dans Nature Catalysis, Les Drs Francesca Paradisi et Martina Contente de l'Université de Nottingham produisent des produits chimiques plus efficacement grâce à un ensemble de réactions en boucle utilisant des enzymes dans le flux. Crédit :Université de Nottingham
Des experts de l'Université de Nottingham ont créé un circuit de réactions autonome qui est une méthode de production chimique plus écologique et plus efficace.
Dans leur article sur la conversion auto-entretenue en boucle fermée multienzymatique des amines en alcools dans des réactions continues, Publié dans Catalyse naturelle , Les Drs Francesca Paradisi et Martina Contente de l'Université de Nottingham produisent des produits chimiques plus efficacement grâce à un ensemble de réactions en boucle utilisant des enzymes dans le flux.
Les réactions réduisent les déchets environnementaux, sont autosuffisants et produisent des qualités supérieures du produit final.
Enzymes en flux, comme utilisé comme une série de « colonnes » remplies d'enzymes immobilisées et d'une solution de support, fait entrer les réactifs et les produits avec des vitesses de réaction beaucoup plus rapides que dans les réactions par lots normales.
Dr Paradisi, Professeur Associé en Biocatalyse et Ingénierie Enzymatique à l'Ecole de Chimie, a expliqué que l'eau est souvent utilisée comme milieu dans lequel des réactions chimiques à médiation enzymatique peuvent avoir lieu, mais que l'élimination des déchets à la fin du processus pose un problème.
Elle a dit:"Votre eau est maintenant quelque peu contaminée par des molécules chimiques qui dérivent de la transformation complexe qui a eu lieu, donc le verser dans les égouts n'est pas respectueux de l'environnement. Le traitement de l'eau contaminée peut être très coûteux.
"Avec la boucle que nous avons créée, l'eau est recyclée, les sous-produits générés sont éliminés en continu et récupérés tout au long du processus, et l'eau propre est à nouveau utilisée comme support pour les réactifs dans la réaction."
La chaîne de réactions a été créée dans une boucle qui s'auto-entretient et signifie que les produits sont créés, purifié, et isolés sans intervention manuelle à chaque étape du processus.
"Imaginez que vous ayez un robinet qui, dans son cours d'eau, produit un produit de valeur parmi les moins précieux. Imaginez que vous avez un tamis qui filtre le produit que vous voulez", dit le docteur Paradisi.
« Alors imaginez si ce robinet pouvait être monté sur une fontaine de recyclage d'eau, maintenant vous savez que l'eau et les produits de moindre valeur (qui ont encore de la valeur) ne sont jamais perdus, ils agissent simplement en tant que transporteur des molécules précieuses.
"Non seulement cela augmente l'efficacité et fait gagner du temps, il crée un système zéro déchet. Nous avons également découvert que travailler de cette manière signifiait que les rendements de certains produits de grande valeur « difficiles à fabriquer » étaient également beaucoup plus élevés que ceux des réactions chimiques traditionnelles, de plus de 20 fois. »
Dans la recherche, qui a été financé par une subvention du Conseil de recherche en biotechnologie et sciences biologiques, le couple utilisait des amines naturellement produites dans l'organisme comme la dopamine, tryptamine et histamines. Ils ont ensuite utilisé la boucle de réactions pour les convertir en alcools tels que le 4-hydroxytyrosol qui est un antioxydant et généralement plus difficile à produire.
Le Dr Paradisi a déclaré :« Ces alcools sont très recherchés dans la création de produits pharmaceutiques, additifs alimentaires, pour créer des parfums et des arômes et ils sont difficiles et très coûteux à produire. Les stratégies chimiques traditionnelles peuvent nécessiter jusqu'à deux semaines pour produire un rendement de 5 à 13 % pour la molécule la plus difficile. Nous avons découvert que nous pouvons produire environ 70 % en 45 minutes. »
Et la recherche ne se limite pas aux alcools car le processus peut être transféré pour créer d'autres produits.
"Les possibilités pour cela sont énormes, il s'agit simplement de la bonne application", ajouta le Dr Paradisi. "Nous pouvons prendre n'importe quelle molécule d'intérêt et voir si nous pouvons la disséquer étape par étape, en pensant quelle enzyme pourrait catalyser la réaction en sens inverse, jusqu'à ce que nous arrivions à un matériau de départ simple. On peut alors assembler les enzymes en séquence, un peu comme créer un bio-système artificiel où le premier produit est le substrat de la prochaine étape enzymatique, jusqu'à ce que la molécule finale soit atteinte. Contrairement à un système biologique, cette usine enzymatique ex-vivo est beaucoup plus robuste, nous pouvons augmenter considérablement la quantité d'enzyme responsable de chaque étape (car elle n'est jamais perdue, il est contenu dans le réacteur), affiner la vitesse relative de chaque réaction, pour des conversions très rapides.
"Nous n'avons pas à nous soucier de l'intégrité de la cellule, ou la toxicité potentielle de la ou des molécules pour le système biologique. Le flux signifie en effet que si chaque étape est optimisée, nous pouvons traiter chaque partie de la cascade comme une entité distincte. Finalement, boucler les eaux usées au début, transportant certains des composants auxiliaires nécessaires au fonctionnement des enzymes, nous augmentons de façon exponentielle la productivité du système. C'est une nouvelle façon de travailler avec des enzymes qui n'a jamais été faite auparavant."