
L'expérience a été réalisée à l'instrument Coherent X-ray Imaging (CXI), qui utilise le rapide, des impulsions de rayons X brillantes de la source de lumière cohérente Linac. CXI applique la méthode de « diffraction avant destruction » pour effectuer des mesures avec des impulsions de rayons X ultracourtes avant qu'elles n'endommagent leurs cibles. Crédit :SLAC National Accelerator Laboratory
Tuberculose, une maladie pulmonaire qui se propage dans l'air par la toux ou les éternuements, tue désormais plus de personnes dans le monde que tout autre agent infectieux, selon le dernier rapport mondial sur la tuberculose de l'Organisation mondiale de la santé. Et dans des centaines de milliers de cas chaque année, le traitement échoue parce que les bactéries qui causent la tuberculose sont devenues résistantes aux antibiotiques.
Aujourd'hui, une équipe internationale de chercheurs a trouvé un nouveau moyen d'étudier comment les bactéries Tb inactivent une importante famille d'antibiotiques :ils ont observé le processus en action pour la première fois à l'aide d'un laser à rayons X à électrons libres, ou XFEL.
Lors d'expériences au laboratoire national d'accélérateurs SLAC du ministère de l'Énergie, ils ont mélangé un antibiotique avec une enzyme appelée bêta-lactamase que les bactéries Tb utilisent, puis regardé en temps réel l'enzyme attaquer l'antibiotique pour le désactiver.
La méthode des chercheurs, appelée cristallographie en série mix-and-inject, profite du brillant, impulsions ultrarapides produites par la source de lumière cohérente Linac (LCLS) du SLAC. Des clichés radiographiques pris 30 millisecondes à 2 secondes après le début de la réaction ont montré la liaison de la lactamase à l'antibiotique, ceftriaxone, et l'éclatement d'une de ses liaisons chimiques.
Les résultats de l'expérience ont été publiés aujourd'hui dans BMC Biologie .
"Cette étude de preuve de concept montre que nous sommes capables de voir la forme et les étapes intermédiaires des molécules au cours du processus, " dit Marius Schmidt, un professeur de l'Université du Wisconsin à Milwaukee qui a dirigé l'expérience. "Après des décennies d'essai d'autres techniques dans le domaine de la cristallographie, la technologie est là."
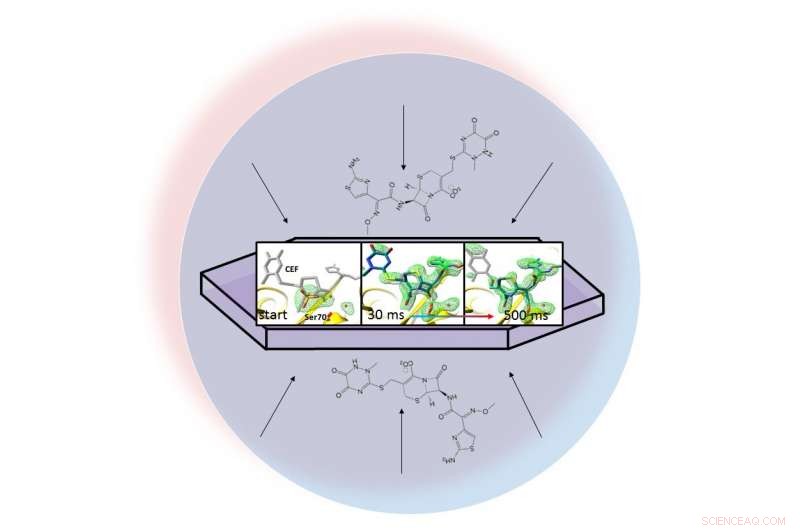
Dans une goutte de liquide (représentée par le cercle bleu clair), un antibiotique se disperse à travers une protéine cristallisée, bêta-lactamase, et s'y attache. Des instantanés aux rayons X de la paire liée ont permis aux chercheurs de créer des cartes de la densité électronique (vert) et de regarder un anneau dans l'antibiotique s'ouvrir (à l'extrême droite) 30 à 500 millisecondes après le début de la réaction. Crédit :Marius Schmidt / Université du Wisconsin Milwaukee
En cristallographie, les scientifiques forment un cristal à partir de nombreuses copies d'une protéine et frappent le cristal avec des rayons X pour produire un diagramme de diffraction sur un détecteur, qui révèle la structure atomique de la protéine. Cette structure est essentielle pour comprendre le fonctionnement des enzymes et d'autres protéines.
Dans le passé, cela ne fonctionnait qu'avec des cristaux relativement gros, qui ont une valeur limitée dans cette méthode car la solution contenant l'antibiotique mettrait beaucoup de temps à diffuser dans le cristal et à réagir avec l'enzyme. Il est important que la diffusion soit plus rapide que la réaction, de sorte que les nombreuses molécules de protéines dans le cristal démarrent ensemble le processus chimique.
Mais LCLS et d'autres XFEL ont des faisceaux si intenses qu'ils peuvent capturer des motifs de diffraction à partir de cristaux beaucoup plus petits, un millionième de mètre de diamètre ou moins, Schmidt a dit, afin que l'antibiotique puisse atteindre l'enzyme rapidement, et la réaction peut être enregistrée avec des rayons X.
"Bien qu'il y ait eu des études élégantes pour observer les mouvements des protéines avec des changements induits par la lumière, notre travail montre qu'une classe plus large de protéines, à savoir les enzymes, peut être étudié de manière résolue en temps au LCLS et à d'autres XFEL, " dit José Olmos, un doctorant à l'Université Rice qui est l'un des principaux auteurs de la publication.
Dans cette étude, l'équipe de recherche a livré de minuscules cristaux de bêta-lactamase tout en les mélangeant avec l'antibiotique quelques fractions de seconde avant qu'ils ne soient frappés par des impulsions de rayons X.
Crédit :CC0 Domaine public
L'équipe a pris des millions d'instantanés aux rayons X pendant la réaction et les a assemblés pour créer une carte qui montre les changements dans la structure tridimensionnelle de l'antibiotique lorsqu'il interagit avec l'enzyme à température ambiante.
"Pour les biologistes structurels, c'est ainsi que nous apprenons exactement comment fonctionne la biologie, " dit Mark Hunter, scientifique du SLAC et co-auteur de l'étude. "On déchiffre la structure d'une molécule à un moment donné, et cela nous donne une meilleure idée du fonctionnement de la molécule."
Dans les expériences futures, prendre encore plus d'instantanés au cours de la réaction pourrait fournir plus de détails sur la structure et le comportement chimique de la lactamase. Avec plus d'informations, les scientifiques pourraient manipuler la conception des antibiotiques pour prévenir de telles attaques. La méthode expérimentale pourrait également être appliquée pour apprendre les détails fins d'autres types de processus biologiques où les enzymes initient ou orientent les réactions.
"Cette méthode suscite beaucoup d'enthousiasme, car il ouvre ce nouveau domaine temporel pour les biologistes structurels, ", dit Hunter. Des travaux antérieurs utilisant cette technique ont capturé le basculement d'un ARN "commutateur, " important pour les études sur les rétrovirus et le cancer.
Les scientifiques prévoient d'utiliser la méthode pour examiner d'autres antibiotiques. Ils ont également l'intention de tirer parti des taux de répétition plus élevés - un déclenchement plus rapide des impulsions de rayons X - attendus lors d'une future mise à niveau vers LCLS et lors du XFEL européen récemment ouvert. Cela permettra aux scientifiques de capturer les données dont ils ont besoin en quelques minutes, par rapport aux jours. Ils pourraient également prendre des instantanés plus rapprochés des réactions, ce qui pourrait donner une image encore plus complète de la chimie rapide telle qu'elle se produit.