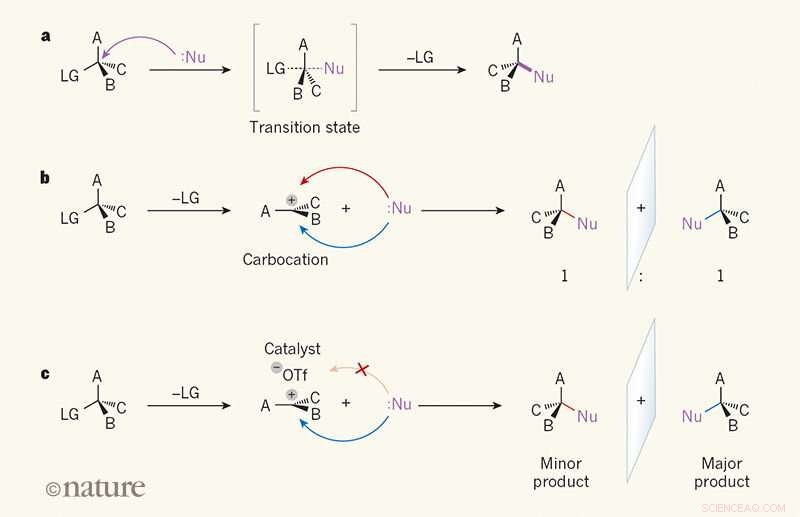
Sélectivité d'image miroir dans les réactions de substitution. une, Dans une réaction SN2, un réactif appelé nucléophile (Nu; les points indiquent une paire isolée d'électrons) attaque un atome de carbone dans une molécule organique du côté opposé à un groupe « partant » (LG). UNE, B et C peuvent être n'importe quel atome ou groupe. A l'état de transition, la liaison entre l'atome de carbone et le LG est en partie rompue, et une liaison entre Nu et l'atome de carbone est partiellement formée (les liaisons partiellement rompues et partiellement formées sont représentées par des lignes en pointillés). Le lien avec le LG se rompt alors, et un seul produit est formé. b, Dans la réaction SN1, le LG est sorti en premier, et un planaire, intermédiaire chargé appelé une forme de carbocation. Parce que le Nu peut attaquer le carbocation aussi facilement de chaque côté, le produit se forme sous la forme d'un rapport 1:1 d'isomères d'image miroir (énantiomères). c, Wendlandt et al.1 rapportent une réaction SN1 dans laquelle un catalyseur à petite molécule et un ion triflate (–OTf) se lient à un côté du carbocation, diriger le nucléophile de l'autre côté. Un énantiomère est donc produit préférentiellement. Crédit: La nature (2018). DOI :10.1038/s41586-018-0042-1
Une équipe de chercheurs de l'Université Harvard aux États-Unis a développé un moyen pour nous une réaction SN1 pour faire des stéréocentres de carbone quaternaire. Dans leur article publié dans la revue La nature , l'équipe décrit comment surmonter la tendance des réactions SN1 à détruire la stéréochimie pour fabriquer le matériau centré sur le carbone. Tobias Morack et Ryan Gilmour de l'Université de Münster en Allemagne, proposer un article de News &Views sur l'étude dans le même numéro de la revue.
Comme le notent les chercheurs, jusqu'à maintenant, il n'y a pas eu de bonne méthode pour faire des stéréocentres quaternaires. Méthodes actuelles, ils notent, ont tendance à être basées sur des substrats prochiraux, qui sont eux-mêmes un défi à relever. Dans ce nouvel effort, l'équipe de Harvard a proposé une nouvelle approche, basée sur la réaction SN1.
Les réactions SN1 sont un pilier des cours d'introduction à la chimie organique, mais ils causent notoirement des ravages avec la stéréochimie. Malgré ça, les chercheurs pensaient qu'ils pouvaient utiliser l'intermédiaire carbocation plat produit dans de telles réactions comme substrat. À cette fin, ils ont proposé une réaction SN1 qui a converti un mélange d'acétate de propargyle (avec des quantités égales d'énantiomères gauche et droit - un racémique) en un mélange avec un centre quaternaire. Un donneur de liaison hydrogène a été utilisé comme catalyseur pour éliminer les matériaux acétoxy qui ont été remplacés par un mélange allyle - le résultat était un seul énantiomère.
Les produits finaux étaient intéressants, Morack et Gilmour notent, parce que les stéréocentres de carbone avaient une large gamme d'orbitales électroniques. Cela signifie qu'ils ont des géométries physiques différentes et réagissent donc différemment. Cela ouvre la porte à leur utilisation pour produire une grande variété de molécules qui pourraient être utilisées dans diverses réactions pour synthétiser de nouveaux produits chimiques.
Les chercheurs notent qu'ils n'ont pas terminé le travail – ils prévoient d'essayer la même approche avec des composés qui ne sont pas aussi stables. Ce faisant, ils reconnaissent, nécessitera l'utilisation d'un catalyseur encore plus réactif. Ils prévoient également d'étudier la possibilité de conduire la réaction avec différents nucléophiles.
© 2018 Phys.org