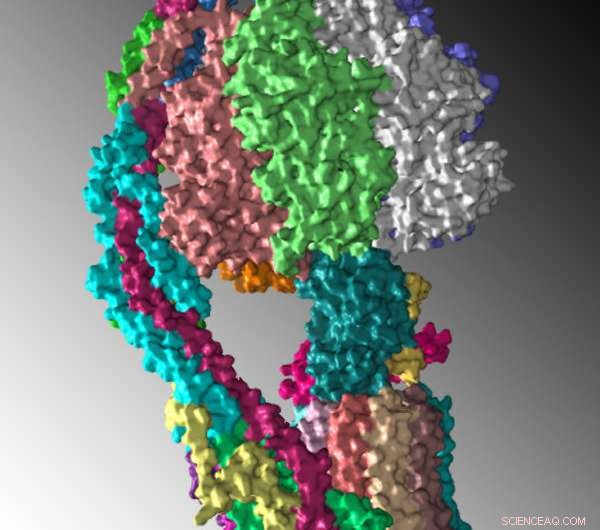
Structure de la levure monomère ATP synthase, montré comme une représentation de surface, déterminé par cryomicroscopie électronique. Crédit :Université Rosalind Franklin
Une équipe de scientifiques dirigée par le professeur David M. Mueller de l'Université Rosalind Franklin, Doctorat, a résolu la structure de l'ATP synthase mitochondriale, une enzyme qui fabrique l'ATP, l'adénosine triphosphate, principale source d'énergie des cellules.
Compte tenu de l'importance de l'ATP synthase dans l'alimentation de la cellule, déterminer la structure complète de l'enzyme a été un Saint Graal scientifique, promettant de révéler des secrets sur la machine ATP qui pourraient conduire à l'identification de cibles thérapeutiques et faire progresser la compréhension des maladies métaboliques et d'autres pathologies cellulaires.
"Comprendre comment l'enzyme fonctionne réellement nécessite la connaissance de sa structure moléculaire tridimensionnelle au niveau atomique, " a déclaré le Dr Mueller, chercheur principal pour l'étude qui a utilisé la cryomicroscopie électronique (cryo-EM) pour révéler l'enzyme à une résolution proche de l'atome.
La première structure complète de l'ATP synthase fournit des preuves du mécanisme par lequel le médicament oligomycine inhibe l'enzyme et comment les mutations causant la maladie perturbent la fonction de la molécule. Résoudre la structure surmonte un obstacle à la compréhension de sa fonction probablement plus large dans les mécanismes de la maladie et des médicaments.
L'étude, publié par la revue Science via la première version le 12 avril, ouvre la voie à la détermination des structures d'autres états fonctionnels de l'ATP synthase, qui fait l'objet d'études structurelles depuis des décennies dans des laboratoires du monde entier.
Dr Mueller, chercheur au Center for Genetic Disease de l'université, a adopté une approche différente en collaboration avec des scientifiques des National Institutes of Health et une équipe de l'Université Harvard. Ils ont utilisé l'analyse cryo-EM pour déchiffrer l'ATP synthase modifiée, qui a été synthétisé dans la levure et reconstitué en nanodisques pour permettre l'analyse structurelle. Bien que cryo-EM ne soit pas nouveau, les progrès technologiques ont permis de résoudre la structure à une résolution proche de l'atome.
"Cette étude illustre comment un effort coordonné des scientifiques peut atteindre un objectif important, " a déclaré le Dr Mueller. "Aucun d'entre nous n'envisageait ce projet de son propre point de vue. Nous étions concentrés sur l'objectif lui-même. Grâce à la collaboration, nous avons résolu un problème qui, individuellement, nous ne pouvions pas."