Crédit :Université d'État de Caroline du Nord
Des chercheurs de la North Carolina State University ont modélisé et analysé les modes de liaison de 210 molécules précédemment signalées comme inhibant la fonction d'une famille d'enzymes impliquées dans la régulation du sel et de la pression artérielle dans le corps humain. Leurs découvertes pourraient aider les chercheurs à mieux comprendre les relations complexes entre la régulation du sel, l'hypertension et l'hypertension artérielle.
La famille d'enzymes sans lysine (WNK) est un groupe de quatre protéines impliquées dans la régulation de la pression artérielle et des fluides corporels. Ces enzymes sont liées à une forme rare et sévère d'hypertension; cependant, leurs fonctions individuelles ne sont pas bien comprises. Pour mieux comprendre le rôle de chaque enzyme, les chercheurs doivent développer des molécules ciblées capables de désactiver sélectivement leur fonction. Les molécules actuellement utilisées se lient aux quatre protéines WNK, empêchant les chercheurs de démêler les différences de fonction entre chacun.
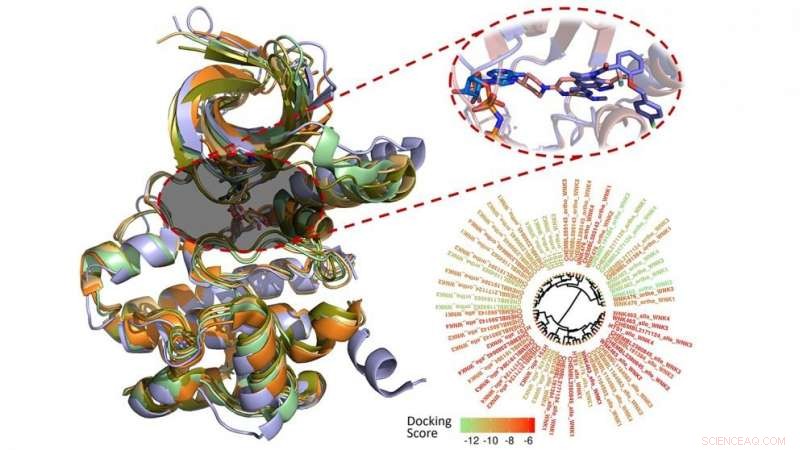
Denis Fourches, professeur assistant de chimie computationnelle, et la chercheuse postdoctorale Melaine Kuenemann ont utilisé la modélisation informatique pour caractériser, analyser et visualiser chacune des 210 molécules connues pour se lier à la famille WNK.
Fourches et Kuenemann ont créé des modèles 3D des 210 composés et les ont ancrés dans la poche de liaison de chaque enzyme WNK. Puis, ils ont mesuré à quel point les composés se sont réellement liés et ont analysé leurs interactions spécifiques au sein des quatre poches de liaison différentes. Ils ont même mené des simulations de dynamique moléculaire en temps réel pour étudier comment ces interactions variaient au fil du temps, révélant de nouvelles façons de rendre les molécules plus sélectives envers une enzyme WNK spécifique.
"Il n'y a pas beaucoup de composés connus pour inhiber la famille des kinases WNK, et celles que nous avons se lient aux quatre enzymes, " dit Fourches. " Si nous voulons mieux comprendre les liens entre ces protéines et l'hypertension, nous devons identifier les produits chimiques qui peuvent arrêter une kinase WNK à la fois et ainsi mieux interroger leur fonction individuelle.
"Il s'agit de la première étude qui tente d'avoir une vue d'ensemble de ces inhibiteurs de WNK à l'aide de simulations informatiques de pointe. Nous espérons que nos découvertes aideront les chimistes médicaux et d'autres chercheurs à concevoir de nouvelles molécules avec une liaison plus élevée puissance et sélectivité envers chaque kinase WNK individuelle."
L'œuvre apparaît dans Informatique moléculaire .