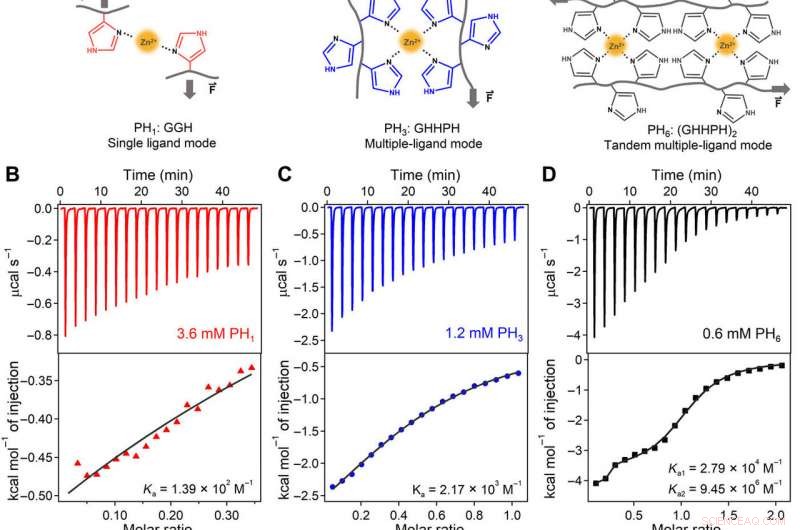
Ingénierie coopérative, constantes de liaison, et mécanisme moléculaire des interactions de coordination des ions métalliques au niveau moléculaire pour la charge. (A) Les complexes de coordination des ions métalliques formés par des ligands simples (PH1, à gauche) sont dynamiques et faibles. Lors de la formation d'un site de chélation des métaux constitué de plusieurs ligands (PH3, milieu), la liaison des ions métalliques devient beaucoup plus forte et moins dynamique que celle des ligands simples. Par ailleurs, lors de l'agencement de deux sites de chélation des métaux en tandem (PH6, droit), l'affinité de liaison, force mécanique, et le taux d'association peut être amélioré grâce à la coopération entre les deux sites. (B à D) Données de titrage ITC de PH1 (gauche), PH3 (milieu), et les peptides PH1 (à droite) avec ZnCl2 dans du tampon tris 1 M (pH 7,60, contenant 300 mM de KCl) à 25°C. (E) Constantes de liaison au Zn2+ (Ka) des peptides PH3 et PH3 mutés. Les acides aminés mutés sont surlignés en rouge. Les barres d'erreur représentent les erreurs d'ajustement. (F) Constantes de liaison au Zn2+ des peptides PH6 et PH6 mutés. Les panneaux gauche et droit correspondent à Ka1 et Ka2 pour les deux sites de liaison de PH6. Seuls les peptides PH6 et (GHHGH)2 présentaient deux constantes de liaison. Le reste des peptides présentait des caractéristiques de liaison à site unique. Les barres d'erreur représentent les erreurs d'ajustement. (G à J) spectres CD de (G) PH1 :GGH; (H) PH3 :GHHPH ; (I) PH6 :(GHHPH)2 ; et (J) des peptides (GHHGH)2 en l'absence et en présence d'ions Zn2+. Les contenus relatifs des structures PPII de PH1 et PH3 sont de 9,6 et 34,2% sur la base de la hauteur du pic majeur de CD à 205 nm, en supposant que le complexe PH6-Zn2+ présente une structure hélicoïdale à 100 % de PPII. (K) Illustration schématique du mécanisme de liaison au Zn2+ coopératif de PH6. Le changement de conformation du premier site de coordination conduit à des changements structurels du second vers une conformation plus favorable à la liaison Zn2+. N / A, n'est pas applicable. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz9531
Les tissus porteurs tels que les muscles et les cartilages présentent généralement une élasticité élevée, ténacité et taux de récupération rapide. Cependant, combiner de telles propriétés mécaniques en laboratoire pour construire des biomatériaux synthétiques est fondamentalement un défi. Dans une nouvelle étude maintenant publiée sur Avancées scientifiques , Wenxu Sun et une équipe de recherche en physique, mécanique d'ingénierie et appareils intelligents en Chine, développé une forte, hydrogel résistant et à récupération rapide. L'équipe a conçu le matériau en utilisant des agents de réticulation avec des interactions dynamiques coopératives. Ils ont conçu un décapeptide riche en histidine (chaîne d'acides aminés 10) contenant deux motifs de liaison en tandem (consécutifs) au zinc (Zn) pour faciliter la stabilité thermodynamique, force de liaison plus forte et taux de liaison plus rapide de la construction, par rapport à des motifs protéiques de liaison simples ou à des protéines ligands isolées. Les hydrogels de réseau hybride modifiés avec le complexe peptide zinc présentaient une stabilité élevée, ténacité et récupération rapide en quelques secondes. L'équipe de recherche s'attend à ce que les échafaudages gèrent efficacement les applications d'ingénierie tissulaire porteuses et fonctionnent comme des blocs de construction pour la robotique douce. Les nouveaux résultats fournissent une voie générale pour régler les propriétés mécaniques et dynamiques des hydrogels au niveau moléculaire.
Quand on marche, nos muscles, le cartilage et les tendons sont soumis à des charges mécaniques importantes, mais les tissus biologiques peuvent récupérer rapidement pour fonctionner de manière fiable pendant de nombreux cycles mécaniques. Les bioingénieurs ont exploré les hydrogels mous dotés de propriétés mécaniques semblables à des muscles en tant qu'actionneurs biomécaniques, cartilage synthétique, muscle artificiel, peau ionique et en robotique douce. Ils ont consacré de nombreux efforts pour améliorer la résistance mécanique et la ténacité des hydrogels en introduisant des mécanismes spéciaux de dissipation d'énergie. La récupération rapide est également une caractéristique unique des tissus mous porteurs, outre la résistance mécanique et la ténacité, mais les hydrogels synthétiques n'ont toujours pas de mécanisme de récupération rapide. Par exemple, les hydrogels traditionnels à double réseau (DN) ou à réseau hybride (HN) avec de courtes chaînes polymères, car les réseaux sacrificiels ne peuvent généralement pas récupérer rapidement, ce qui prend souvent de quelques minutes à plusieurs jours.
La résistance d'un hydrogel dépend de la durée de vie de ses agents de réticulation, où des cinétiques de liaison/déliaison lentes conduisent à des hydrogels puissants, tandis que les taux de change rapides donnent des taux faibles. Pour obtenir une résistance et une ténacité élevées, les agents de réticulation doivent être lents, mais pour obtenir une récupération rapide, les agents de réticulation doivent être dynamiques avec des taux élevés d'association et de dissociation. Pour surmonter cette contradiction, les matériaux porteurs naturels ont utilisé la coopérativité des interactions faibles. Dans ce travail, Soleil et al. des hydrogels de réseau hybride (HN) de conception similaire avec un complexe peptide-métal spécialement conçu comme agent de réticulation physique. L'équipe a formé des sites de liaison métalliques efficaces dans une séquence peptidique pour concevoir des hydrogels dotés des caractéristiques requises.
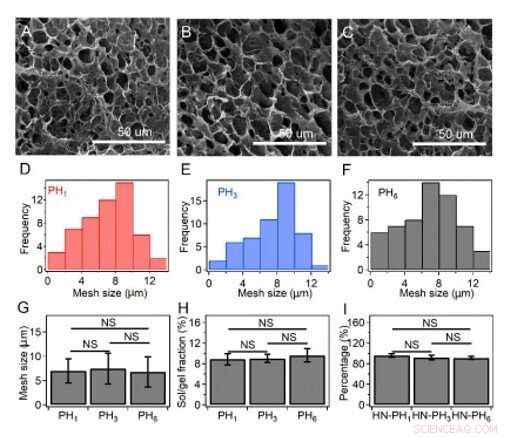
Taille des mailles, fractions sol/gel, et le pourcentage réel de peptides incorporés au réseau d'hydrogel. (A-C) images SEM du gel HN-PH1 (A), le gel HN-PH3 (B) et le gel HN-PH3 (C) avant d'ajouter les ions Zn2+. (D-F) Distributions de taille de maille du gel HNPH1 (D), Gel HN-PH3 (E) et gel HN-PH6 (F) estimés à partir des images SEM à l'aide du logiciel ImageJ. (G) Taille de maille moyenne des gels HN-PHn en l'absence d'ions Zn2+. (H) Fractions sol/gel de différents gels HN-PHn avant l'ajout de zinc. (I) Le pourcentage de peptides incorporés dans le réseau d'hydrogel. Les concentrations initiales de peptide étaient de 0,3 M, 0,10 M, et 0,05 M pour PH1, PH3, et PH6, respectivement. Le pourcentage des peptides incorporés dans les hydrogels était similaire, tel qu'estimé en soustrayant la fraction de peptides élués de la quantité totale utilisée. Les barres d'erreur indiquent la moyenne ± S.D. NS :p> 0,05. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz9531
L'équipe a d'abord conçu trois courts peptides riches en histidine (HR-peptides) comme ligands pour se lier aux ions zinc (Zn
2+
) et construire des hydrogels HN. Ils ont noté les séquences peptidiques comme PH
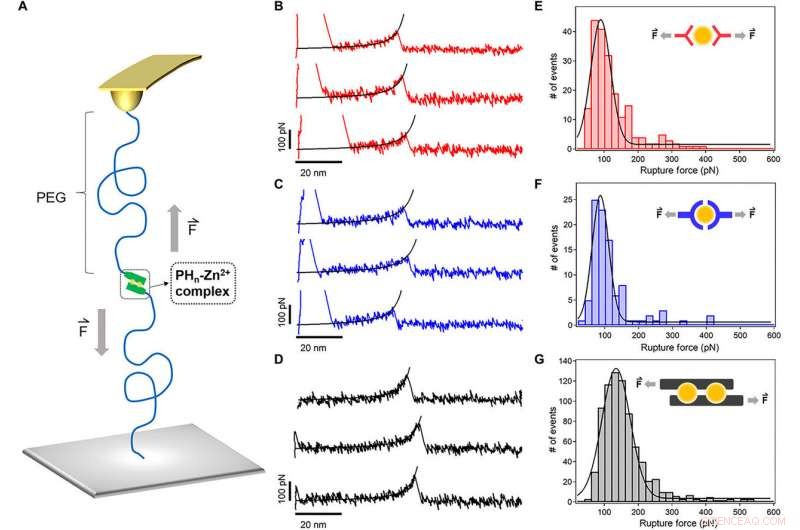
Spectroscopie de force à molécule unique des complexes de coordination des ions métalliques. (A) Diagramme schématique des expériences de spectroscopie de force à molécule unique basée sur l'AFM. Les ligands peptidiques ont été liés à la pointe en porte-à-faux et au substrat via un lieur PEG (MW, 5 kDa). (B à D) Courbes force-extension typiques pour la rupture de PH1-Zn2+ (rouge), PH3-Zn2+(bleu), et les complexes PH6-Zn2+ (noir) à une vitesse de traction de 1000 nm s-1. L'ajustement en chaîne en forme de ver des courbes force-extension (lignes noires) a confirmé que le pic à une extension d'environ 50 nm correspond à la rupture d'une liaison de chélation d'un seul ion métallique. (E à G) Les histogrammes des forces de rupture pour PH1-Zn2+ (rouge), PH3-Zn2+(bleu), et PH6-Zn2+ (noir), respectivement. L'ajustement gaussien montre les forces de rupture moyennes de 90 ± 29, 87 ± 24, et 135 ± 41 pN, respectivement. Les modes de liaison des ions Zn2+ proposés pour les trois peptides sont présentés dans les encarts. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz9531
Soleil et al. utilisé des techniques avancées telles que la spectroscopie de force à molécule unique (SMF) basée sur la microscopie à force atomique (AFM) pour mesurer la stabilité mécanique du peptide HR-Zn
2+
complexes, c'est-à-dire des agents de réticulation de l'hydrogel au niveau moléculaire. Les forces de rupture moyennes étaient beaucoup plus élevées pour PH
The team explored if changes to the intrinsic properties of crosslinkers could alter macroscopic mechanical properties of the hydrogel by preparing a series of hybrid network (HN) hydrogels. They used HR-peptide-Zn
2+
as sacrificial crosslinkers and covalent bonds as permanent crosslinkers in the constructs and named the resulting hydrogels as HN-PH

Compressing the HN-PH6 hydrogel using a sharp blade does not damage the material. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz9531
The team conducted tensile mechanical tests on the gels and correlated the results on the bulk level with those at the molecular level, to show remarkably higher break strain, Young's modulus and toughness for the HN-PH
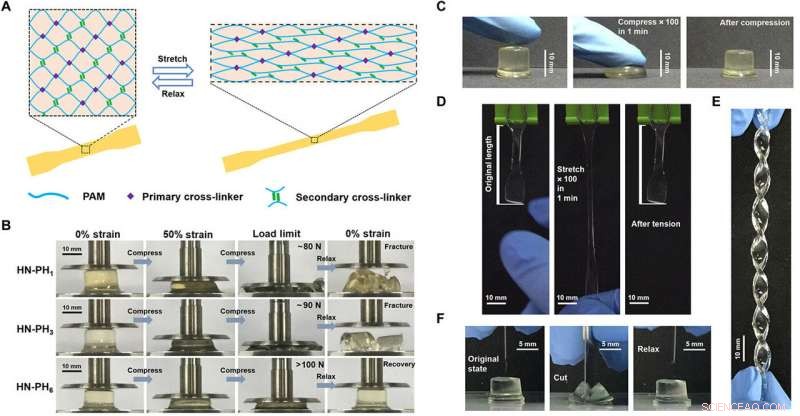
Structure and properties of HN-PHn HN hydrogels cross-linked by the peptide-Zn2+ coordination complexes. (A) Schematic illustration of the network structure of HN-PHn hydrogels. The network comprises covalent bonds as the primary cross-linkers and ligand-metal interactions as the secondary cross-linkers. (B) Optical images of the HN-PH1 (top), HN-PH3 (middle), and HN-PH6 (bottom) hydrogels under a compression-relaxation cycle. The HN-PH1 and HN-PH3 gels were fractured, whereas the HN-PH6 gel was almost fully recovered. (C) Optical images of the HN-PH6 gel under an extreme compressive condition (compressed to>70% strain for 100 times at 1.6 Hz). (D) Optical images of the HN-PH6 gel under an extreme tensile condition (stretched to>150% strain for 100 times at 1.6 Hz). (E) Optical image of the HN-PH6 gel twisted into a spiral shape. (F) Optical images of the HN-PH6 gel compressed with a sharp blade and relaxed. No detectable cut was observed on the gel. PAM, polyacrylamide. Photo credits:Wenxu Sun, Nanjing University. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaz9531
De cette façon, Wenxu Sun and colleagues developed a novel hydrogel material, bioinspired by histidine residues found in natural load-bearing materials. Combining such outstanding mechanical properties in the lab has remained a challenge due to the inability to effectively harness the unique metal ion binding properties that are encoded in natural proteins. Dans ce travail, Sun et al. used bioinspired Zn 2+ -binding peptide as crosslinkers to form the desired hydrogels at the molecular level, highlighting the importance of cooperative metal coordination during materials synthesis. They intend to examine additional mechanical features, such as adhesion to other tissues, before conducting practical applications in tissue engineering.
© 2020 Réseau Science X