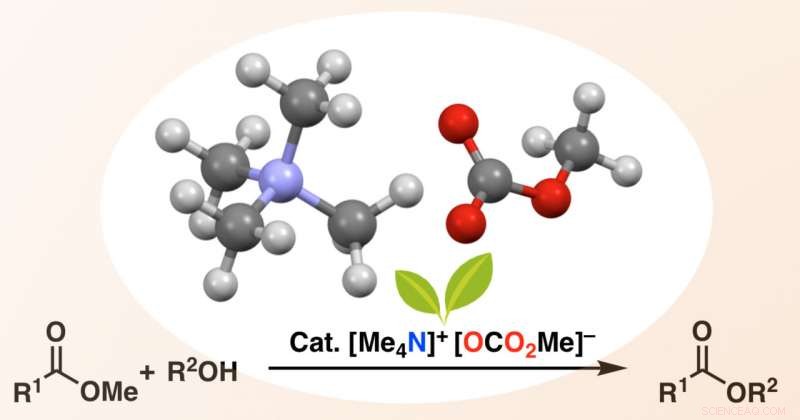
Le carbonate de méthyle de tétraméthylammonium (TMC) réagit in situ avec un alcool pour former un ion alcoxyde, qui attaque ensuite l'ester de départ pour donner l'ester cible complexe avec des rendements élevés. Crédit :Manabu Hatano &Kazuaki Ishihara
Les esters font partie des classes de composés les plus importantes en chimie organique. Les esters simples sont connus pour leur agréable, arômes souvent fruités. Pendant ce temps, le plus grand, les exemples plus complexes ont un large spectre d'utilisations industrielles, allant des lentilles et crèmes hydratantes au carburant « vert » (biodiesel).
Une façon courante de produire des esters complexes consiste à faire réagir des esters carboxyliques plus simples avec des alcools. Connue sous le nom de trans-estérification, ce processus repose généralement sur des sels métalliques comme catalyseurs. Cependant, de tels catalyseurs ont tendance à être coûteux et/ou polluants. Pire encore, si l'ester est long et souple, il a tendance à s'enrouler autour du centre métallique par des liaisons de coordination. En attachant efficacement le métal, cette "chélation" arrête la réaction.
Maintenant, une équipe de l'Université de Nagoya a développé un catalyseur qui élargit considérablement la gamme de substrats de trans-estérification. Pour éviter la chélation, les chercheurs ont utilisé un catalyseur sans métal, carbonate de méthyle de tétraméthylammonium (TMC). Dans les bonnes conditions, Le TMC réagit in situ avec un alcool pour former un ion alcoxyde, qui attaque ensuite l'ester de départ pour donner l'ester cible complexe avec des rendements élevés.
Selon Manabu Hatano, co-auteur de l'étude de l'équipe en Chimie verte , ce n'est pas le premier procédé utilisant des alcoxydes pour la trans-estérification, mais c'est de loin le plus polyvalent. "Les efforts précédents ont utilisé des sels de phosphonium, mais l'alcoxyde résultant ne peut estérifier que le solvant lui-même, qui doit être du carbonate de diméthyle (DMC). C'est bien si vous voulez un produit qui peut être dérivé de DMC, mais sinon, vous avez besoin de sels stables dans des solvants plus conventionnels. Notre nouveau TMC comble cette lacune."
La gamme d'alcools et d'esters qui peuvent être combinés à l'aide de TMC est en effet large. Les alcools aminés peuvent participer, même si le groupe amino désactiverait les catalyseurs métalliques typiques par chélation. Un dérivé de quinine avec un cycle ponté 3-D du côté alcool a également été construit. Pendant ce temps, parmi les substrats esters, les esters d'acides aminés chiraux peuvent être mis à réagir avec succès, et la pureté de l'énantiomère correct est préservée en toute sécurité. Comme les sels de phosphonium antérieurs, le nouveau catalyseur peut également être utilisé pour estérifier le solvant lui-même, ce qui permet d'économiser de l'argent lorsque le solvant est en route vers la cible.
"Etant à la fois recyclable et exempt de métaux, ce catalyseur est un véritable exemple de chimie verte, " dit l'auteur principal Kazuaki Ishihara. " Non seulement le processus lui-même est vert, mais nous pouvons l'utiliser pour produire du biodiesel vert, qui est un mélange d'esters. Nous avons synthétisé des centaines de grammes d'un composant majeur du biodiesel, ce qui est assez copieux pour une réaction à l'échelle du laboratoire. Cela nous donne l'assurance que la réaction peut être étendue à la production industrielle. »