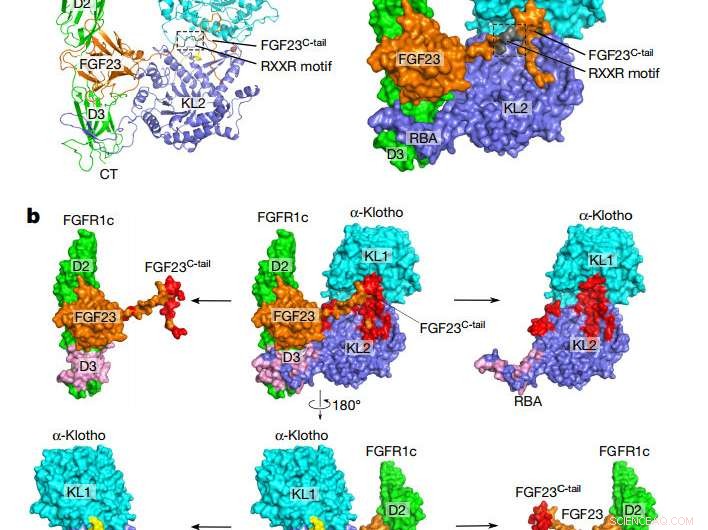
Topologie globale du complexe FGF23–FGFR1cecto–α-klothoecto. une, Caricature (à gauche) et représentation surfacique (à droite) de la structure complexe ternaire. Les domaines α-klotho KL1 (cyan) et KL2 (bleu) sont reliés par un court linker riche en proline (jaune; non visible dans la présentation de surface). Le FGF23 est en orange avec son motif de clivage protéolytique en gris. FGFR1c est en vert. CT, Terminaison C ; NT, Terminaison N. b, Interfaces de liaison entre α-klothoecto et le complexe FGF23-FGFR1cecto. Le complexe ternaire (au centre) est représenté dans deux orientations différentes liées par une rotation de 180° le long de l'axe vertical. Les interfaces FGF23–α-klothoecto (rouge) et FGFR1cecto–α-klothoecto (rose) sont visualisées en éloignant l'une de l'autre α-klothoecto et le complexe FGF23–FGFR1cecto. Les composants séparés sont représentés à gauche et à droite du complexe ternaire. Crédit: La nature (2018). DOI :10.1038/nature25010
Une nouvelle étude révèle la structure moléculaire d'une protéine appelée alpha(α)Klotho, et comment il aide à transmettre un signal hormonal qui ralentit le vieillissement.
Dirigé par des chercheurs de la NYU School of Medicine et publié en ligne le 17 janvier dans La nature , l'étude réfute 20 ans de conjectures selon lesquelles αKlotho - du nom de la déesse grecque qui tisse le fil de la vie - est une hormone anti-âge majeure. Au lieu de cela, les résultats attribuent cette fonction au facteur de croissance des fibroblastes 23 (FGF23), et expliquez comment αKlotho aide simplement le FGF23 à médier son action anti-âge.
Des études remontant à 1997 avaient montré que des souris génétiquement manipulées pour manquer de αKlotho ou de FGF23 souffraient de vieillissement prématuré, y compris les maladies cardiovasculaires à début précoce, cancer, et le déclin cognitif. En fournissant un premier aperçu de la structure du groupe de protéines associé qui comprend le FGF23, sa protéine réceptrice (FGFR), et Klotho, la présente étude renverse le dogme selon lequel αKlotho agit à lui seul comme facteur de longévité.
"En montrant que toutes les façons dont αKlotho était censé protéger les organes proviennent plutôt de sa capacité à aider le signal FGF23, nous avons jeté un nouvel éclairage sur la cause sous-jacente du vieillissement, " déclare l'auteur principal de l'étude, Moosa Mohammadi, Doctorat, professeur au Département de biochimie et de pharmacologie moléculaire de NYU Langone Health. "Nos nouvelles données structurelles ouvrent également la voie à la conception de nouveaux agents qui peuvent encourager ou bloquer la signalisation FGF23-αKlotho selon les besoins."
La structure résout le mystère
Pour déterminer la structure atomique du groupe de protéines de signalisation FGF23, Mohammadi et ses collègues ont utilisé la cristallographie aux rayons X. L'équipe a d'abord cajolé l'hormone FGF23, avec sa protéine réceptrice (FGFR) et αKlotho, décanter une solution et former des piles de répétition, cristaux ordonnés. Ils ont ensuite exposé les cristaux aux rayons X, et utilisé les modèles réfléchis pour calculer la structure atomique des protéines.
La nouvelle étude fournit la première preuve de la façon dont le FGF23 ne peut signaler aux cellules qu'en formant un complexe avec αKlotho, son récepteur, et un autre partenaire dans le sulfate d'héparane. Fabriqué par des cellules osseuses, l'hormone FGF23 est connue pour voyager via la circulation sanguine vers les cellules d'autres organes, où il délivre son message en s'amarrant et en allumant son récepteur. La structure complexe nouvellement résolue révèle comment αKlotho attache le FGF23 à son récepteur avec suffisamment de ténacité pour l'activer.
L'étude jette également un nouvel éclairage sur la façon dont la maladie rénale entraîne un épaississement anormal du tissu musculaire cardiaque appelé hypertrophie. L'hypertrophie cardiaque est l'une des principales causes de décès chez les personnes atteintes de tubules rénaux endommagés, causée (par exemple) par l'hypertension artérielle et le diabète. Lorsque les tubules rénaux endommagés ne peuvent plus éliminer adéquatement le phosphate dans l'urine, FGF23 augmente dans un effort pour contrôler le phosphate sanguin, en partie en contrôlant les niveaux de vitamine D. Une hypothèse dominante a été que des niveaux très élevés de FGF23 provoquent une hypertrophie dans le cœur, mais la théorie est restée controversée car le tissu cardiaque n'a pas de Klotho, qui doit être présent si FGF23 doit signaler.
Des études antérieures avaient montré que la forme la plus connue de αKlotho est immobile, étant lié aux membranes de surface des cellules dans les tubules rénaux, la glande parathyroïde, et certaines régions du cerveau. Ensuite, les chercheurs ont appris qu'une partie de la protéine αKlotho qui dépasse de la surface des cellules, le domaine ecto, peut être coupé et versé dans les fluides corporels en circulation, et pourrait donc atteindre le cœur. Les premières preuves, cependant, ont suggéré que le Klotho versé était incapable d'agir en tant que co-récepteur du FGF23. La nouvelle étude intègre ces observations en montrant que le Klotho circulant peut en effet fonctionner comme sa forme liée à la membrane pour permettre la signalisation du FGF23.
Les chercheurs affirment que leurs découvertes lanceront une autre course au développement de médicaments contre les maladies rénales. Mohammadi avait déjà montré qu'un élément clé de l'hormone FGF23 (son peptide de queue C-terminal), lorsqu'il est injecté à des souris, rivalise avec le FGF23 intact pour réduire son signal et prévenir l'hypertrophie cardiaque. En outre, l'équipe conçoit déjà de nouvelles molécules qui modifient le signal FGF23/shed αKlotho sur la base des structures protéiques nouvellement découvertes.
L'étude suggère également qu'une protéine apparentée, bêta-Klotho, sert du même type de corécepteur pour aider FGF21, une hormone apparentée au FGF23. FGF21 fonctionne en envoyant des signaux qui maintiennent l'équilibre de la glycémie et des acides gras, avec des implications pour le diabète et l'obésité.