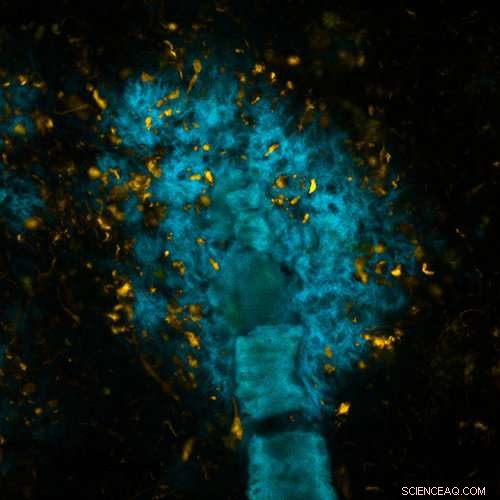
Tissu cérébral atteint de la pathologie d'Alzheimer, coloré avec l'une des nouvelles molécules spécifiques de tau (orange) et l'une des molécules précédemment développées par le groupe à LiU (bleu). L'image a été prise dans un microscope à fluorescence. Crédit :Peter R Nilsson
De petites molécules brillantes développées par des scientifiques de l'Université de Linköping en Suède peuvent être conçues pour distinguer les plaques de différentes protéines dans le cerveau. Ils peuvent ouvrir la voie à un meilleur diagnostic des maladies neurodégénératives, comme la maladie d'Alzheimer, dans laquelle la plaque se forme à partir des protéines amyloïdes bêta ou tau.
Chercheurs de l'Université de Linköping, LiU, ont découvert que de petits changements dans la structure de molécules traceuses connues peuvent leur permettre de reconnaître soit le bêta-amyloïde, soit le tau. Ces petites molécules, qui ont été précédemment développés par les chercheurs, se lier à une protéine cible spécifique. Lorsque les molécules sont illuminées, ils émettent un signal sous forme de lumière à une longueur d'onde différente.
"Cela ouvre la possibilité de développer des outils de diagnostic plus avancés pour les maladies dans lesquelles la bêta-amyloïde et la tau sont impliquées, " dit Peter Nilsson, professeur au Département de physique, Chimie et biologie. Il a dirigé l'étude, qui vient d'être présenté dans la revue scientifique Chimie – Une revue européenne .
Dans plusieurs maladies du cerveau, longues fibres de forme protéique, et finissent par s'emmêler pour former des corps denses connus sous le nom de « plaque » ou « agrégats ». La maladie d'Alzheimer, qui provoque la démence, est un exemple bien connu, dans laquelle la plaque se compose généralement de variantes défectueuses de deux protéines :bêta-amyloïde et tau. Mais des dépôts de la protéine tau dans le cerveau sont également observés dans un groupe d'affections moins courantes appelées « tauopathies ».
Dans les années récentes, plusieurs cas de lésions cérébrales chez des personnes relativement jeunes ayant une carrière sportive professionnelle ont fait couler beaucoup d'encre. L'encéphalopathie traumatique chronique (CTE) peut survenir chez les personnes ayant reçu des coups répétés à la tête, comme cela peut se produire dans les sports de contact comme la boxe, hockey sur glace et football américain. Un autre groupe à risque est celui des soldats professionnels. Le seul moyen actuellement disponible pour parvenir à un diagnostic ferme est l'autopsie. Ainsi, il y a un besoin urgent d'outils de diagnostic qui peuvent être utilisés pour enquêter sur des personnes vivantes, et cela peut distinguer les dépôts de bêta-amyloïde et de tau dans le cerveau.
Ce qui rend ces molécules uniques, c'est qu'elles ont des squelettes flexibles et s'adaptent à la structure de la protéine à laquelle elles sont liées. Lorsque la molécule change de configuration, la couleur de la lumière qu'il émet change. Les chercheurs ont commencé avec une molécule traceuse qui ne se lie et ne reconnaît que les agrégats de bêta-amyloïde. Ils ont adapté cette molécule pour qu'elle devienne plus similaire aux molécules qui avaient été développées par d'autres groupes de chercheurs et qui se lient au tau. Ils ont fait deux variantes, et il s'est avéré que l'une des molécules se lie très étroitement et exclusivement au tau, tandis que l'autre variante était totalement inadaptée.
"Nous voyons que des changements extrêmement minimes, juste déplacer quelques atomes, peut amener la molécule traceuse à se lier préférentiellement à un autre type d'agrégat. Cela signifie que nous pouvons adapter les molécules pour reconnaître différents agrégats, en fonction de la protéine présente, " dit Peter Nilsson.
Les chercheurs prévoient maintenant de développer davantage les molécules traceuses en les marquant avec des radio-isotopes, utilisé lors de la tomographie par émission de positons (TEP). Un énorme avantage des investigations TEP est qu'elles peuvent être réalisées sur des personnes vivantes.
« Si nous pouvons développer des outils de diagnostic plus avancés capables de faire la distinction entre le bêta-amyloïde et le tau, il serait possible de déterminer quel agrégat de protéines se forme en premier et comment les agrégats interagissent. Il serait également possible de rechercher si différentes formes de traitement sont efficaces contre un type de granulat sans affecter l'autre, " dit Peter Nilsson.