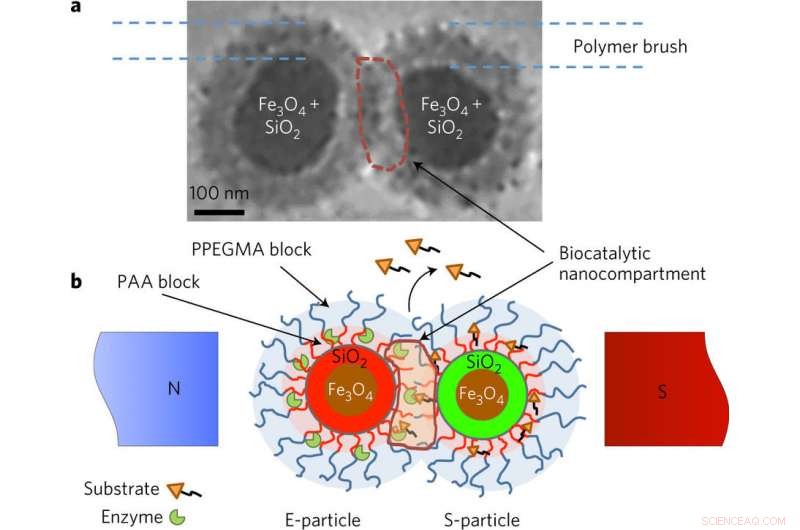
Nanoparticules superparamagnétiques de type E et S portant l'enzyme et le substrat. une, b, Image (a) et schéma (b) de la microscopie électronique à cryotransmission (cryo-MET) expliquant le concept de la biocatalyse déclenchée par un champ magnétique. Le noyau superparamagnétique des particules est constitué de nanoparticules de Fe3O4 enveloppées de silice. L'enveloppe de silice est marquée avec des colorants fluorescents liés de manière covalente (rouge pour les particules E et vert pour les particules S). Dans le champ magnétique, en raison des interactions dipôle-dipôle, les particules sont mises en contact, de sorte que les coquilles à double couche en forme de brosse se confondent et s'entrelacent, permettant des interactions entre l'enzyme et le substrat. Les couches internes de la brosse sont en acide polyacrylique (PAA), qui porte des molécules conjuguées d'enzymes et de substrats et fournit l'environnement acide pour les réactions hydrolytiques. L'enveloppe externe du polymère de poly(éthylène glycol méthyl éther acrylate) (PPEGMA) assure une fonction barrière pour bloquer les réactions « non autorisées » ou prématurées de l'enzyme et du substrat. La réaction biocatalytique est localisée au sein du nanocompartiment biocatalytique, qui est généré dans le champ magnétique. La réaction est surveillée en détectant les molécules cargo libérées. Crédit :(c) Catalyse naturelle (2017). DOI :10.1038/s41929-017-0003-3
(Phys.org) - Une équipe de chercheurs de l'Université de Géorgie à Athènes a développé une technique pour contrôler les réactions chimiques qui libèrent des médicaments à l'intérieur du corps. Dans leur article publié dans la revue Catalyse naturelle , le groupe décrit des produits chimiques de revêtement pour empêcher une réaction de se produire jusqu'à l'application d'un champ magnétique qui libère un médicament souhaité.
Dans certaines applications médicales, il est préférable pour un traitement médical qu'un produit chimique puisse être appliqué directement sur une certaine partie du corps et nulle part ailleurs. Les produits chimiques destinés à traiter les tumeurs en sont le meilleur exemple :les médicaments de chimiothérapie agissent sur chaque cellule avec laquelle ils entrent en contact, provoquant une foule d'effets secondaires négatifs. Dans ce nouvel effort, le groupe a adopté une nouvelle approche pour résoudre ce problème, en utilisant un aimant pour forcer les produits chimiques enrobés ensemble, provoquant une réaction de libération du médicament.
Pour fournir un moyen de contrôler le moment où les produits chimiques entrent en contact à l'intérieur du corps, les chercheurs ont créé de minuscules paquets en enduisant d'abord des nanoparticules d'oxyde de fer avec de la silice, puis en les enduisant de deux types de polymères, lequel, lorsqu'ils sont combinés, forment une structure en forme de brosse. Chacun des paquets a ensuite été chargé avec une enzyme ou un substrat destiné à réagir avec l'enzyme, et, bien sûr, le médicament à libérer.
En pratique, les paquets seraient libérés dans le corps d'un patient, où ils feraient leur chemin vers tout le corps, se comporter de manière inoffensive, car les brosses les empêchent de réagir chaque fois qu'elles se rencontrent. Lorsque les paquets se sont dirigés vers un site où une réaction était souhaitée, le chercheur a appliqué un aimant qui les a forcés à se rapprocher suffisamment près pour qu'ils puissent réagir, libérer le médicament. Les autres paquets non impliqués dans la réaction seraient lentement évacués du corps naturellement, sans faire de mal.
Les chercheurs ont testé leurs sachets in vitro en utilisant un véritable médicament de chimiothérapie et des cellules cancéreuses. Ils rapportent que cela a fonctionné exactement comme ils l'avaient envisagé. Plus de tests sont nécessaires, bien sûr, pour s'assurer que la technique est sûre, mais si tout va bien, il pourrait éventuellement être utilisé pour traiter une grande variété de cancers.
© 2017 Phys.org