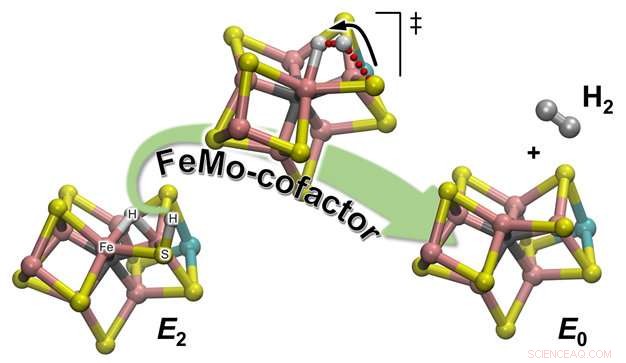
Illustration schématique de la formation de H2 à partir de l'un des intermédiaires enzymatiques réactionnels (E2) pour régénérer l'état de repos (E0) du cofacteur catalytique de la nitrogénase, appelé cofacteur FeMo. L'atome d'hydrogène lié à l'un des atomes de soufre initie un voyage qui le conduira à la rencontre du partenaire avec lequel il formera la molécule H2 :un hydrogène hydrique qui attend patiemment, assis entre deux atomes de Fe. Crédit :Laboratoire national du Nord-Ouest du Pacifique
La nitrogénase est au cœur de la vie sur notre planète. Il fournit la plupart de l'azote (N) utilisé dans les protéines et les acides nucléiques et il est essentiel à la création de plantes, animaux et autres organismes, faire de l'ammoniac (NH3) qui est ensuite utilisé dans la biosynthèse des acides aminés puis des protéines. Mais pendant que la nitrogénase est à l'œuvre, il crée aussi autre chose :du dihydrogène (H2). Les scientifiques savent depuis un certain temps que la nitrogénase produit du H2 par deux processus différents. Maintenant, l'un de ces processus est clair grâce aux travaux d'une équipe de chercheurs qui ont étudié le mécanisme de production d'H2.
La nitrogénase produira H2 si elle est exécutée en l'absence de N2. Cela a été considéré comme une « relaxation » du site actif de l'enzyme qui est chargé d'hydrures de fer nécessaires à la réaction de réduction de N2. Mais quel est le mécanisme par lequel les hydrures de fer du site actif de la nitrogénase se sont détendus pour produire ce H2 ? Une équipe de scientifiques du Pacific Northwest National Laboratory, Université d'État de l'Utah, Université du nord-ouest, et l'Université de l'Utah a cherché à comprendre ce mécanisme de relaxation H2 en surveillant les effets de l'hydrogène (H) par rapport au deutérium (D) sur la cinétique de la formation de H2 lorsque la nitrogénase est attachée à une électrode. L'équipe a découvert qu'un H+ voisin était en fait le partenaire actif dans la production de H2 lorsqu'il se combine avec l'hydrure de fer pour produire du H2.
"Un seul proton fait tout, l'hydrure n'est qu'un simple spectateur attendant une action, " a confirmé Simone Raugei, un scientifique du PNNL impliqué dans ce travail.
Il s'agit d'une étape importante vers la compréhension de la nitrogénase et comment et pourquoi la production de H2 est nécessaire à son activité. Il illustre également une stratégie d'étude mécanistique qui peut être appliquée à d'autres enzymes oxydoréductases et à des complexes biomimétiques.
Pour isoler la cinétique de production d'hydrogène, une équipe dirigée par Lance Seefeldt, Brian Hoffmann, Shelley Minter, et Simone Raugei a utilisé de petites molécules pour transporter rapidement des électrons d'une électrode à la moitié catalytique de la nitrogénase. Suivre les réactions des protons était une tâche délicate et stimulante, dit Seefeldt, afin d'assurer la précision, ils ont surveillé l'« inventaire » de protons (le nombre d'hydrogènes impliqués dans la production catalytique de H2) en effectuant des mesures cinétiques d'hydrogène/deutérium cinétiques.
Les résultats des expériences ont suggéré qu'un seul hydrogène était réellement impliqué dans l'étape limitante de la formation de H2, et non deux comme l'indique la stoechiométrie de la réaction.
Les observations expérimentales de l'équipe ont été confirmées par la chimie computationnelle, qui a fourni une description atomistique détaillée du mécanisme de réaction. Il existe 2 types d'hydrogènes dans le cofacteur catalytique (appelé FeMo-co) :l'un situé dans une position de pontage où il se lie à deux atomes de fer (un hydrure de pontage), et un sur les ligands d'un atome de soufre à proximité (essentiellement un atome de soufre protoné :S-H). Il s'avère que lors de l'évolution de H2, ce dernier est le partenaire actif. La liaison S-H se brise et le H+ résultant se déplace vers l'hydrure de pontage et le protone en formant H2 :les calculs fournissent une explication de l'observation expérimentale selon laquelle un seul hydrogène est « actif, " tandis que l'autre n'est qu'un simple spectateur attendant l'arrivée de son partenaire.
"Le niveau de concordance entre les observations et les résultats de chimie computationnelle était remarquablement élevé, ", a déclaré Raugei.
Ce travail est une étape critique vers une compréhension mécanistique de l'enzyme nitrogénase. Il reste encore du travail à faire pour comprendre le mécanisme de l'autre processus d'évolution de H2 qui conduit à la liaison de N2, Activation, et réduction en NH3.