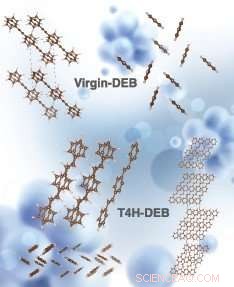
Structures cristallines simulées de vierge-DEB et T4H-DEB (chimiquement connu sous le nom 1, 4-distyrylbenzène, un isomère trans du produit intermédiaire DEB après la capture des 4 premiers atomes d'hydrogène avec 2 liaisons CH sur les côtés opposés de la chaîne carbonée). Les structures en haut à gauche et en haut à droite correspondent à la vue latérale et à la vue de dessus du DEB vierge, respectivement. Au milieu à droite, les structures en bas à droite et en bas à gauche correspondent à la vue latérale, vue de dessus et une cellule unitaire (vue latérale) de T4H-DEB, respectivement. Crédit :La simulation a été réalisée par Hom Sharma. Le rendu artistique de l'image a été réalisé par Alexandria Holmberg Diaz, Laboratoire national Lawrence Livermore.
L'excès d'hydrogène peut causer des problèmes dans une variété d'industries. Il peut corroder les semi-conducteurs, électronique, et le combustible nucléaire entreposé. Il présente également un risque d'explosion. Pour éliminer cet hydrogène supplémentaire, les chimistes peuvent utiliser un composé organique appelé getter d'hydrogène qui se lie chimiquement à plusieurs atomes d'hydrogène.
Mais parfois, au cours de ce processus de liaison - appelé hydrogénation catalytique - les produits partiellement hydrogénés deviennent volatils, fondre et s'évaporer avant de pouvoir se lier à plus d'atomes d'hydrogène. Maintenant, les chercheurs ont exploré comment et pourquoi cette volatilité varie au cours de l'hydrogénation, suggérant qu'un effet auparavant sous-estimé des liaisons carbone-hydrogène dans la molécule est le principal coupable.
La nouvelle analyse, publié dans Le Journal de physique chimique , peut aider les chimistes à identifier les conditions idéales nécessaires à l'hydrogénation catalytique afin qu'ils puissent mieux éliminer l'excès d'hydrogène.
"Cela crée un modèle pour le comportement d'autres getters organiques, nous permettant de prédire leurs températures et environnements de fonctionnement optimaux, " dit Long Dinh, un physicien au Lawrence Livermore National Laboratory.
Dinh et ses collègues se sont concentrés sur un getter appelé 1, 4 bis(phényléthynyl)benzène, ou DEB. Pour éliminer l'hydrogène, des flocons de cristal de DEB sont mélangés avec des catalyseurs sous forme de pastilles solides. Les pastilles sont constituées de charbon actif, dont la structure poreuse offre une surface abondante, enrobés de nanoparticules de palladium. Le catalyseur au palladium divise les molécules d'hydrogène en atomes d'hydrogène, qui peut alors se lier au DEB et former des liaisons carbone-hydrogène.
DEB est un getter haute capacité, capable de se lier avec jusqu'à huit atomes d'hydrogène. La plupart des chercheurs pensaient que lorsque les getters comme le DEB se lient à plus d'atomes d'hydrogène et s'agrandissent, ils deviennent plus volatils. À des températures de fonctionnement élevées, ils peuvent alors se vaporiser, dériver loin des pastilles catalytiques où il n'y a pas d'atomes d'hydrogène avec lesquels se lier. "Vous arrêtez prématurément le processus d'hydrogénation, " dit Dinh.
Mais les chercheurs ont découvert que dans les deux premières étapes de l'hydrogénation, lorsque DEB forme deux liaisons carbone-hydrogène par étape (les liaisons carbone-hydrogène sont créées de part et d'autre de la chaîne carbonée de la molécule), la molécule diminue en fait de volatilité. Ce n'est que dans les étapes ultérieures de l'hydrogénation que le DEB devient plus volatil.
Pour étudier comment et pourquoi DEB change de volatilité, les chercheurs ont mesuré des propriétés telles que les pressions de vapeur et les points de fusion, structure moléculaire sondée, et a exécuté des simulations informatiques de mécanique quantique pour modéliser le processus d'hydrogénation. Leur analyse suggère que les liaisons carbone-hydrogène dans le DEB jouent un rôle clé dans le comportement volatil de la molécule.
Lors de l'hydrogénation, l'hydrogène se lie aux atomes de carbone dans le DEB. Selon la pensée conventionnelle, la liaison carbone-hydrogène qui en résulte n'est pas polaire - aucune extrémité de la structure en barre n'est chargée plus négativement ou positivement que l'autre. Mais il s'avère que l'extrémité carbone est légèrement plus négative, et la liaison carbone-hydrogène forme un dipôle faible, Dinh a expliqué.
En tant que dipôle, une liaison carbone-hydrogène peut attirer ou repousser d'autres liaisons carbone-hydrogène dans d'autres molécules de DEB. Selon la façon dont les liaisons carbone-hydrogène sont agencées et combien il y a dans les produits DEB intermédiaires, les molécules peuvent s'attirer ou se repousser, et donc être moins ou plus volatile, respectivement. Des recherches antérieures avaient négligé ces interactions collectives entre les liaisons carbone-hydrogène dans les cristaux organiques, dit Dinh.
De leur analyse, les chercheurs ont déterminé que les conditions optimales pour l'hydrogénation du DEB sont inférieures à environ 175 degrés Fahrenheit, si c'est fait dans un bon vide. "Nos résultats, " Dinh dit, "peut être appliqué de manière analogue à d'autres systèmes catalytiques d'absorption d'hydrogène organique."