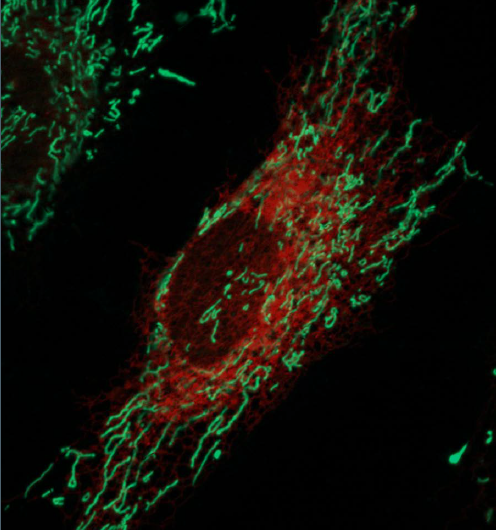
Cellules HeLa imagées en direct avec le réticulum endoplasmique marqué en rouge et les mitochondries marquées en vert. Crédit :Ginam Cho.
À l'intérieur de chaque cellule se trouve une infrastructure complexe d'organites remplissant différentes fonctions. Les organites doivent échanger des signaux et des matériaux pour que la cellule fonctionne correctement. Les nouvelles technologies permettent aux chercheurs de voir et de comprendre les réseaux qui relient ces organites, leur permettant de construire des cartes des routes commerciales qui existent dans une cellule. Une étude à paraître dans le numéro du 29 septembre de la Journal de chimie biologique rapporte l'utilisation d'une méthode émergente pour identifier des protéines qui permet à deux organites, les mitochondries et le réticulum endoplasmique, s'attacher les uns aux autres.
"Pensez à [une organelle] comme un ferry accostant sur un site, déchargement et chargement des passagers et des voitures, puis aller sur un autre site et faire la même chose, " a déclaré Jeffrey Golden, un professeur au Brigham and Women's Hospital et à la Harvard Medical School qui a supervisé le travail. « Leur capacité à accoster, charge, et décharger la cargaison nécessite des guides ou des rampes de largeur et de hauteur spécifiques qui relient le bateau et la terre ou ils ne peuvent pas charger et décharger librement. »
Les points de contact entre le réticulum endoplasmique (RE) et les mitochondries sont ces "rampes" et "guides" qui permettent ces contacts. Ils permettent des activités importantes comme la signalisation, échange de calcium et de lipides, et le contrôle de la physiologie mitochondriale. Des connexions défectueuses entre le RE et les mitochondries ont été impliquées dans plusieurs maladies neurodégénératives, dont la maladie d'Alzheimer, La maladie de Parkinson et la maladie de Huntington. Les protéines qui relient et relient le RE et les mitochondries sont bien étudiées chez la levure, mais les connexions entre ces organites dans les organismes multicellulaires comme les mammifères sont plus complexes et moins comprises.
Le collaborateur de Golden Ginam Cho et le chercheur Il-Taeg Cho ont eu l'idée de rechercher des protéines importantes pour le contact ER-mitochondrial en utilisant une méthode récemment développée pour montrer le contact entre les protéines. La méthode tire parti d'une enzyme appelée ascorbate peroxydase, ou APEX, qui peut attacher la biotine communément appelée vitamine B7 aux protéines à proximité. L'équipe a conçu des cellules pour produire des mitochondries qui avaient APEX attaché à leurs membranes externes, puis ajouté de la biotine aux cellules pour que l'APEX l'utilise pour marquer les protéines voisines.
L'équipe a ensuite isolé des parties de la cellule qui contenaient l'ER, purifié les protéines auxquelles la biotine était attachée, et identifié ceux trouvés dans l'ER en utilisant la spectrométrie de masse. Parce que l'APEX était attaché aux mitochondries, seules les protéines qui se trouvaient à proximité des mitochondries pouvaient avoir de la biotine attachée. Ainsi, la biotine servait en quelque sorte de tampon de passeport qui indiquait quelles protéines avaient été impliquées dans le contact RE-mitochondries.
"Auparavant, il était possible de ne regarder qu'une molécule à la fois pour évaluer avec quoi elle interagissait, " Golden a déclaré. " La méthode que nous avons utilisée est plus rapide et permet un regard impartial sur l'ensemble du système et ce qui se passe à l'interface de cet organite. "
En utilisant cette méthode de dépistage, les chercheurs se sont concentrés sur une protéine ER appelée RTN1a, qui était auparavant connu pour contribuer à la forme de l'ER. Dans les expériences de suivi, ils ont confirmé que cette protéine aidait également les mitochondries à se fixer au RE.
Cette étude soulève la possibilité que des défauts de RTN1a pourraient contribuer aux problèmes rencontrés par les patients atteints de maladies neurodégénératives, mais les chercheurs ne le sauront pas avec certitude jusqu'à ce qu'ils mènent des expériences supplémentaires, y compris des études similaires dans les cellules neurales.
Golden suppose que les protéines importantes pour le contact ER-mitochondrial pourraient être différentes dans différents types de cellules.
"Le foie utilise-t-il les mêmes protéines pour contrôler ces types d'interactions que les cellules neurales ? Une [protéine] est-elle plus importante pour l'échange de calcium et un autre ensemble de protéines plus important pour l'échange de lipides ?" demanda Golden. "Je pense qu'il y a beaucoup de biologie cellulaire que nous ne connaissons tout simplement pas et que l'on pourrait répondre [en utilisant cette méthode]."
L'équipe utilise maintenant la méthode de spectrométrie de masse APEX pour comparer les protéines impliquées dans les contacts ER-mitochondries entre les cellules neurales normales et celles dérivées du patient.
"Il y a beaucoup de choses intéressantes que nous pouvons faire, " a déclaré Il-Taeg Cho.