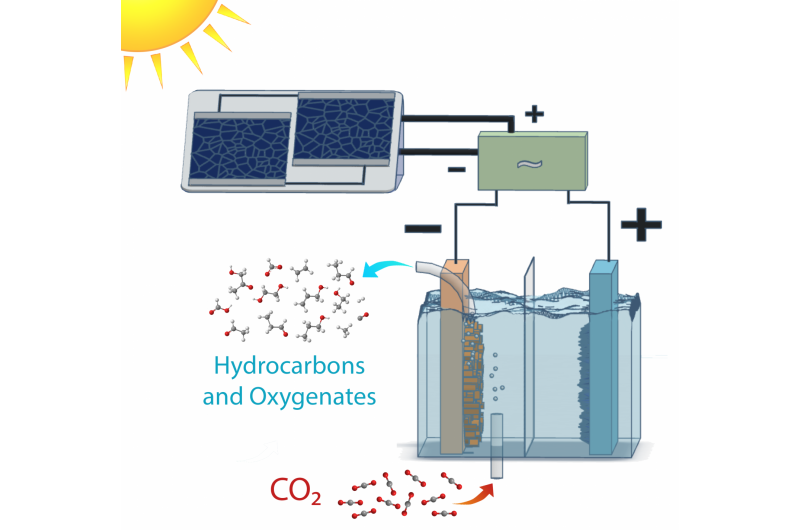
Schéma d'une cellule d'électrolyse à énergie solaire qui convertit le dioxyde de carbone en produits hydrocarbonés et oxygénés avec une efficacité bien supérieure à la photosynthèse naturelle. L'électronique d'adaptation de puissance permet au système de fonctionner dans une gamme de conditions d'ensoleillement. Crédit :Clarissa Towle/Berkeley Lab
Les scientifiques du Lawrence Berkeley National Laboratory (Berkeley Lab) du ministère de l'Énergie ont exploité le pouvoir de la photosynthèse pour convertir le dioxyde de carbone en carburants et en alcools avec des rendements bien supérieurs à ceux des plantes. Cette réalisation marque une étape importante dans l'effort visant à s'orienter vers des sources de carburant durables.
De nombreux systèmes ont réussi à réduire le dioxyde de carbone en précurseurs chimiques et de carburant, comme le monoxyde de carbone ou un mélange de monoxyde de carbone et d'hydrogène connu sous le nom de gaz de synthèse. Ce nouvel ouvrage, décrit dans une étude publiée dans la revue Sciences de l'énergie et de l'environnement , est le premier à démontrer avec succès l'approche consistant à passer directement du dioxyde de carbone aux produits cibles, à savoir l'éthanol et l'éthylène, à des rendements de conversion d'énergie rivalisant avec leurs homologues naturels.
Les chercheurs l'ont fait en optimisant chaque composant d'un système photovoltaïque-électrochimique pour réduire les pertes de tension, et créer de nouveaux matériaux lorsque ceux existants ne suffisaient pas.
"C'est un développement passionnant, " a déclaré le chercheur principal de l'étude, Joel Ager, un scientifique du Berkeley Lab avec des nominations conjointes dans les divisions Sciences des matériaux et Sciences chimiques. « Alors que la hausse des niveaux de CO2 atmosphérique modifie le climat de la Terre, la nécessité de développer des sources d'énergie durables est devenue de plus en plus urgente. Notre travail ici montre que nous avons une voie plausible pour fabriquer des carburants directement à partir de la lumière du soleil. »
Cette voie du soleil au carburant fait partie des objectifs clés du Centre commun pour la photosynthèse artificielle (JCAP), un centre d'innovation énergétique du DOE créé en 2010 pour faire avancer la recherche sur les combustibles solaires. L'étude a été menée sur le campus de Berkeley Lab de JCAP.
L'objectif initial de la recherche du JCAP était de s'attaquer à la séparation efficace de l'eau dans le processus de photosynthèse. Ayant largement accompli cette tâche en utilisant plusieurs types d'appareils, Les scientifiques du JCAP qui effectuent une réduction du dioxyde de carbone à l'aide de l'énergie solaire ont commencé à viser des efficacités similaires à celles démontrées pour la séparation de l'eau, considéré par beaucoup comme le prochain grand défi de la photosynthèse artificielle.
Un autre groupe de recherche du Berkeley Lab s'attaque à ce défi en se concentrant sur un composant spécifique d'un système photovoltaïque-électrochimique. Dans une étude publiée aujourd'hui, ils décrivent un nouveau catalyseur capable de convertir le dioxyde de carbone en multicarbone en utilisant des apports d'énergie record.
Pas seulement pour midi
Pour cette étude JCAP, les chercheurs ont conçu un système complet pour fonctionner à différents moments de la journée, pas seulement à un niveau d'énergie lumineuse d'un éclairage solaire, ce qui équivaut au pic de luminosité à midi élevé par une journée ensoleillée. Ils ont fait varier la luminosité de la source lumineuse pour montrer que le système restait efficace même dans des conditions de faible luminosité.
Lorsque les chercheurs ont couplé les électrodes à des cellules photovoltaïques au silicium, ils ont atteint des rendements de conversion solaire de 3 à 4 pour cent pour un éclairage de 0,35 à 1 soleil. Changer la configuration pour une haute performance, une cellule solaire en tandem connectée en tandem a donné une efficacité de conversion en hydrocarbures et en oxygène dépassant 5 pour cent à 1 illumination solaire.

À gauche, une vue de surface d'une cathode bimétallique de nanocorail cuivre-argent prise à partir d'une micrographie électronique à balayage. À droite se trouve une image aux rayons X à dispersion d'énergie de la cathode avec le cuivre (en rose/rouge) et l'argent (en vert) mis en évidence. Crédit :Gurudayal/Berkeley Lab
"On a fait une petite danse au labo quand on a atteint 5%, " dit Ager, qui détient également un poste de professeur adjoint au département de science et d'ingénierie des matériaux de l'UC Berkeley.
Parmi les nouveaux composants développés par les chercheurs figurent une cathode nanocorail cuivre-argent, qui réduit le dioxyde de carbone en hydrocarbures et en oxygène, et une anode en nanotubes d'oxyde d'iridium, qui oxyde l'eau et crée de l'oxygène.
"La caractéristique intéressante du nanocorail est que, comme les plantes, il peut fabriquer les produits cibles dans un large éventail de conditions, et c'est très stable, " dit Ager.
Les chercheurs ont caractérisé les matériaux au Centre national de microscopie électronique de la fonderie moléculaire, une installation utilisateur du DOE Office of Science au Berkeley Lab. Les résultats les ont aidés à comprendre comment les métaux fonctionnaient dans la cathode bimétallique. Spécifiquement, ils ont appris que l'argent aide à réduire le dioxyde de carbone en monoxyde de carbone, tandis que le cuivre s'y accumule pour réduire davantage le monoxyde de carbone en hydrocarbures et alcools.
Chercher mieux, ruptures à basse énergie
Parce que le dioxyde de carbone est une molécule obstinément stable, le rompre implique généralement un apport important d'énergie.
"La réduction du CO2 en un produit final hydrocarboné comme l'éthanol ou l'éthylène peut prendre jusqu'à 5 volts, indemnite, " a déclaré l'auteur principal de l'étude, Gurudayal, stagiaire postdoctoral au Berkeley Lab. "Notre système a réduit cela de moitié tout en maintenant la sélectivité des produits."
Notamment, les électrodes fonctionnaient bien dans l'eau, un environnement à pH neutre.
« Les groupes de recherche travaillant sur les anodes le font principalement dans des conditions alcalines, car les anodes nécessitent généralement un environnement à pH élevé, ce qui n'est pas idéal pour la solubilité du CO2, " a déclaré Gurudayal. " Il est très difficile de trouver une anode qui fonctionne dans des conditions neutres. "
Les chercheurs ont personnalisé l'anode en faisant croître les nanotubes d'oxyde d'iridium sur une surface d'oxyde de zinc pour créer une surface plus uniforme afin de mieux soutenir les réactions chimiques.
"En travaillant si soigneusement chaque étape, ces chercheurs ont démontré un niveau de performance et d'efficacité que les gens ne pensaient pas possible à ce stade, " a déclaré Frances Houle, chimiste du Berkeley Lab, directeur adjoint de la JCAP pour l'intégration de la science et de la recherche, qui ne faisait pas partie de l'étude. "C'est un grand pas en avant dans la conception de dispositifs pour une réduction efficace du CO2 et le test de nouveaux matériaux, et il fournit un cadre clair pour l'avancement futur des dispositifs solaires entièrement intégrés de réduction du CO2.