Crédit :HIMS
Des chimistes travaillant dans le domaine prioritaire de recherche Chimie durable de l'Université d'Amsterdam (UvA) ont collaboré avec le Laboratoire du futur Solvay à Bordeaux pour développer une boîte à outils pratique permettant de prédire la solubilité de petites molécules dans différents solvants. Ces outils sont disponibles en libre accès et gratuitement, et peut améliorer la sélection des solvants et les formulations de nombreux produits industriels.
Les solvants sont extrêmement importants pour de nombreux secteurs industriels. Souvent, dans la formulation d'un produit chimique, le solvant constitue l'essentiel de l'entité. Il est également crucial pour la fonction du produit. Par exemple, avec la bonne formulation de solvant, les pesticides restent plus longtemps sur les feuilles après la pluie, les peintures et les encres sèchent plus rapidement, et les cosmétiques s'appliquent plus facilement. Connaître la solubilité des molécules est donc essentiel pour le développement de produits.
Le problème des petites molécules
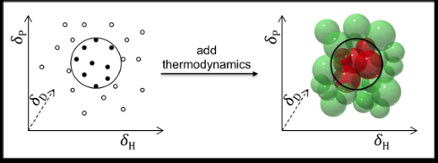
La prédiction de la solubilité est généralement effectuée à l'aide des paramètres de solubilité de Hansen :dispersion (D), interactions polaires (P), et une liaison hydrogène (H). L'industrie des revêtements et polymères, par exemple, obtient d'excellents résultats en utilisant ces paramètres pour prédire la solubilité des polymères.
En principe, Les paramètres de Hansen peuvent également être utilisés pour trouver des solvants pour des molécules plus petites comme les médicaments et les cosmétiques. Mais là les prédictions ne sont pas aussi satisfaisantes, pour deux raisons :l'une, parce que les médicaments et les cosmétiques ont généralement des groupes fonctionnels plus variés; et deux, parce que les paramètres originaux de Hansen excluent les considérations thermodynamiques concernant le mélange, fusion et dissolution. Ceci est acceptable pour les polymères (où la thermodynamique s'annule) mais pas pour les petites molécules.
Dr Manuel Louwerse et Pr Gadi Rothenberg, en collaboration avec l'équipe du Dr Bernard Roux chez Solvay, ont maintenant amélioré le modèle de Hansen et l'ont adapté pour gérer les solutés de petites molécules en incluant la thermodynamique du mélange, fusion et dissolution. Les améliorations sont basées sur une meilleure description des termes d'entropie et d'enthalpie. Lorsqu'un composé se dissout, les molécules quittent le cristal et se mélangent au solvant. Cela augmente l'entropie, mais coûte généralement une certaine enthalpie. Le problème clé ici est que la quantité d'entropie gagnée par le mélange détermine la quantité d'enthalpie qui peut être perdue tout en gardant un G négatif (en d'autres termes, maintenir la force motrice de la dissolution). Puisque l'effet d'entropie dépend de la concentration, la température, et la taille des molécules, ceux-ci devraient tous être inclus.
Une autre amélioration a été apportée en divisant les contributions des donneurs et accepteurs d'électrons entre le solvant et le soluté. Ceci est particulièrement important pour des cas comme la liaison hydrogène, ce qui est pertinent pour de nombreux solvants et solutés. Le mantra « comme se dissout comme » est trop simpliste ici. Des liaisons hydrogène se forment entre donneurs et accepteurs, donc il faut des donneurs pour dissoudre les accepteurs, et vice versa. En divisant les contributions du donneur et de l'accepteur de chaque solvant et soluté, l'équipe UvA a obtenu des modèles plus précis.
Les nouveaux modèles sont bien meilleurs pour prédire la solubilité des petites molécules dans les solvants et les mélanges de solvants. Des tests sur un vaste ensemble de données industrielles de 15 solutés différents et 48 solvants et leurs mélanges au Solvay Lab of the Future ont montré que les qualités d'ajustement s'amélioraient de 0,89 à 0,97. Le pourcentage de prédictions correctes est passé de 54 % à 78 %. Puisque le simple fait de deviner donnerait déjà 50 % de prédictions correctes, c'est une sérieuse amélioration. Un autre avantage important est que le nouveau modèle permet des prédictions à des températures extrapolées.
Les résultats et les modèles sont publiés sous forme d'article en libre accès dans la revue internationale à comité de lecture ChemPhysChem . Le document a déjà soulevé de nombreux commentaires, et les améliorations sont maintenant intégrées dans une version plus récente du logiciel HSPiP.
Bien que la plupart des données réelles de formulation industrielle soient confidentielles, l'équipe conjointe a publié en libre accès la description complète de la théorie et des modèles. Ils ont également inclus les routines Matlab complètes et annotées dans les informations de support, permettre à chacun d'utiliser ces nouveaux outils pour concevoir de nouveaux mélanges et formulations de solvants.
Le professeur Rothenberg considère la publication d'outils comme la clé du succès des partenariats public-privé entre l'industrie et le monde universitaire. « Les partenaires industriels doivent garder leurs données confidentielles, mais la plupart d'entre eux se rendent compte que la publication en libre accès des méthodes et des outils crée de la bonne volonté et permet des développements ultérieurs tant par les collaborateurs que par les concurrents. En partageant méthodes et outils, les entreprises peuvent bénéficier des connaissances des autres sans sacrifier les données.'