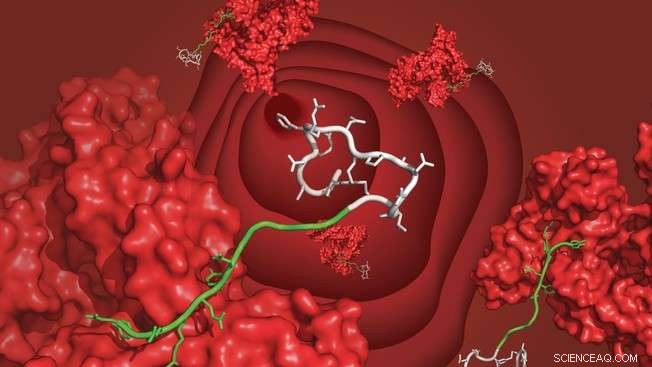
Un peptide bicyclique (blanc) lié à l'albumine sérique (rouge) via le ligand nouvellement développé (vert), flottant dans le sang. Crédit :C. Heinis/EPFL
Des scientifiques de l'EPFL ont développé une molécule de ligand qui relie les médicaments peptidiques à l'albumine sérique et les empêche d'être éliminés trop tôt par les reins. Le ligand est facile à synthétiser et peut prolonger la demi-vie des peptides thérapeutiques de quelques minutes à plusieurs jours.
Les peptides sont des molécules biologiques, constitué de courtes séquences d'acides aminés. Parce qu'ils sont faciles à synthétiser, montrer une faible toxicité et une efficacité élevée, des peptides tels que l'insuline et d'autres hormones peuvent être utilisés comme médicaments. Mais les peptides sont rapidement éliminés par les reins, ce qui signifie que nous ne pouvons utiliser que des médicaments peptidiques qui agissent en quelques minutes. Ce problème peut être surmonté en connectant des peptides à des ligands qui se lient aux protéines du sérum sanguin telles que l'albumine, permettant au peptide de s'attarder plus longtemps dans la circulation sanguine. Des scientifiques de l'EPFL ont maintenant développé un tel ligand, qui est facile à synthétiser et a une grande affinité pour l'albumine humaine. Publié dans Communication Nature , le nouveau ligand pourrait potentiellement prolonger la demi-vie des peptides de quelques minutes à plusieurs jours.
Les peptides combinent un certain nombre de caractéristiques intéressantes pour les médicaments :faible toxicité et réactions immunitaires, haute affinité et efficacité pour leurs cibles, et une synthèse chimique accessible. Le seul problème est la « clairance rénale » :les peptides sont généralement éliminés par les reins quelques minutes après leur entrée dans le sang du patient. Par exemple, l'un des peptides les plus courants, insuline, a une demi-vie sanguine de seulement 4 à 6 minutes. Une autre hormone, l'ocytocine, administrée par voie intraveineuse pour déclencher ou accélérer le travail, a une demi-vie de 10 à 15 minutes.
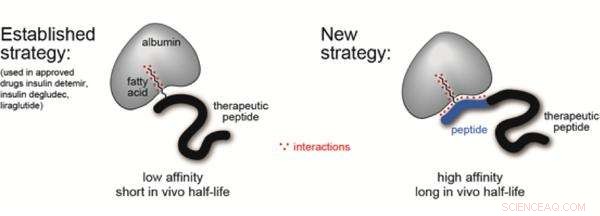
Des délais aussi courts imposés par la clairance rénale limitent sévèrement le potentiel thérapeutique de ces médicaments potentiellement idéaux. Une manière prometteuse d'augmenter la demi-vie des peptides est de les "ajouter" aux protéines du sérum sanguin, comme l'albumine, qui est la protéine la plus abondante dans le sérum sanguin et a une demi-vie de dix-neuf jours. Ceci cependant, nécessite une molécule de ligand intermédiaire qui peut être attachée au peptide lors de la synthèse, et ont également une affinité et une sélectivité élevées pour l'albumine humaine.
Le laboratoire de Christian Heinis à l'EPFL a maintenant développé un tel ligand, qui a une grande affinité pour l'albumine humaine et, plus important encore, est facile à synthétiser et à attacher à un peptide. Le ligand est fabriqué en fusionnant un acide gras avec un autre peptide. La molécule résultante est appelée « chimère » et combine le meilleur des deux mondes du domaine des ligands de l'albumine.
Crédit :Ecole Polytechnique Fédérale de Lausanne
Les efforts précédents ont construit des ligands basés sur des acides gras ou des peptides, et les ai essayés sur l'insuline. Mais alors que les acides gras prolongeaient quelque peu la demi-vie de l'insuline, ils ne se lient généralement pas très fortement à l'albumine. D'autre part, les ligands peptidiques se lient bien à l'albumine, mais a montré une faible solubilité, ce qui signifie qu'il ne distribue pas très bien l'insuline dans le sang.
Le nouveau ligand rassemble littéralement les avantages des acides gras et des peptides. Les chercheurs ont recherché une séquence d'acides aminés qui compléterait la faible liaison de l'acide gras à l'albumine. En utilisant une méthode de synthèse et de criblage « itérative » élégante, ils ont découvert une séquence peptidique qui augmente la liaison de l'acide gras vingt-sept fois. Le ligand chimère final se lie à l'albumine humaine avec une haute affinité (Kd =39 nM), est très soluble, et peut être ajouté à des médicaments peptidiques en utilisant des techniques de synthèse standard.
Les chercheurs ont démontré in vivo que le ligand prolonge la demi-vie de plusieurs peptides bioactifs de plus de 25 fois. Ils ont ensuite ajouté le ligand à un peptide réel développé pour traiter la thrombose pathogène, qui a une courte demi-vie notoirement peu pratique. Il a été démontré que le ligand prolonge l'efficacité du peptide de plusieurs heures, inhibant la maladie chez le lapin.
« Nous nous attendons à ce que l'étiquette présentée dans notre travail intéresse un public plus large de la recherche et des affaires car elle est applicable à pratiquement toutes les fractions peptidiques, y compris les petites protéines, " dit Heinis. " Le ligand peut être ajouté à n'importe quel peptide pendant la synthèse peptidique en phase solide sur des synthétiseurs standard, le rendant facilement accessible pour les laboratoires universitaires et industriels."
La technologie innovante peut également être appliquée pour moduler les propriétés pharmacocinétiques des peptides bicycliques développés par Bicyclic Therapeutics, une startup co-fondée par Christian Heinis et Sir Greg Winter (MRC LMB Cambridge, Royaume-Uni) en 2009, et dont l'EPFL est actionnaire. Le 1er juin de cette année, Bicycle Therapeutics a reçu un investissement de série B de 52 millions de dollars américains. L'objectif de la société est la plate-forme de produits de peptides bicycliques (vélo), qui combine les propriétés de plusieurs entités thérapeutiques en une seule modalité :présentant l'affinité et la pharmacologie sélective associées aux anticorps; la cinétique de distribution des petites molécules, permettant une pénétration rapide de la tumeur ; et la demi-vie pharmacocinétique « ajustable » et la clairance rénale des peptides.